Polimixina B ou Colistina?
Essa é uma das decisões mais críticas na medicina intensiva moderna — e o dilema farmacológico que define a era das superbactérias.
Com a escalada de infecções por Acinetobacter baumannii, Pseudomonas aeruginosa e Enterobacterales resistentes a carbapenêmicos, as polimixinas — antibióticos descobertos há quase 80 anos — voltaram ao centro da prática clínica, não por inovação, mas por necessidade.
Porém, sob o mesmo nome, escondem-se diferenças profundas. A Polimixina B, administrada já em sua forma ativa, atinge concentrações terapêuticas de modo rápido e previsível. Já a Colistina, administrada como o pró-fármaco colistimetato de sódio (CMS), depende de uma conversão lenta e variável — um obstáculo clínico relevante, especialmente em pacientes críticos.
A compreensão dessas distinções não é apenas farmacológica; é estratégica. Saber quando escolher uma ou outra pode significar a diferença entre eficácia e falha terapêutica, entre segurança e nefrotoxicidade. Este artigo analisa, à luz das evidências mais recentes, por que a Polimixina B é hoje o agente preferencial para infecções sistêmicas graves, enquanto a Colistina permanece útil em nichos específicos, como infecções urinárias.
FAQ: Polimixina B vs. Colistina na Prática Clínica
Aqui estão 20 perguntas e respostas cruciais para gestores hospitalares, membros da CCIH, médicos, farmacêuticos e enfermeiros sobre o uso de polimixinas.
1. O que são as polimixinas e por que voltaram a ser tão importantes?
As polimixinas (Polimixina B e Polimixina E/Colistina) são uma classe de antibióticos polipeptídicos que atuam rompendo a membrana de bactérias Gram-negativas. Elas foram descobertas na década de 1940, mas seu uso foi limitado por décadas devido à sua toxicidade, principalmente renal. Com o avanço da resistência bacteriana a outras classes de antibióticos, como os carbapenêmicos, as polimixinas ressurgiram como uma das últimas opções terapêuticas para infecções graves causadas por superbactérias como Acinetobacter baumannii, Pseudomonas aeruginosa e Klebsiella pneumoniae.
- Referências:
2. Qual a principal diferença entre a Polimixina B e a Colistina (Polimixina E)?
A diferença fundamental está na sua farmacocinética. A Polimixina B é administrada em sua forma ativa, atingindo rapidamente níveis terapêuticos no sangue. Já a Colistina é administrada como um pró-fármaco inativo, o colistimetato de sódio (CMS), que precisa ser convertido na forma ativa no organismo. Essa conversão é lenta e variável entre os pacientes, o que pode resultar em níveis sanguíneos subterapêuticos.
3. Para infecções sistêmicas graves, qual das duas é a mais indicada?
Para infecções sistêmicas (fora do trato urinário), a Polimixina B é geralmente a preferida. Por ser administrada na forma ativa, ela proporciona concentrações plasmáticas mais rápidas, previsíveis e eficazes, o que é crucial no tratamento de pacientes críticos.
- Referências:
4. E para infecções do trato urinário (ITU)?
Nesses casos, a Colistina pode ser a melhor escolha. Como o pró-fármaco (CMS) é excretado e convertido na forma ativa nos rins, a Colistina atinge altas concentrações na urina, tornando-a mais eficaz para o tratamento de ITUs. A Polimixina B, por outro lado, tem uma excreção renal muito baixa.
5. Qual delas apresenta maior risco de nefrotoxicidade?
Historicamente, ambas são conhecidas pela alta nefrotoxicidade. No entanto, estudos mais recentes e metanálises sugerem que a Colistina está associada a um maior risco de lesão renal em comparação com a Polimixina B. Isso pode ser explicado pelas altas concentrações do pró-fármaco nos rins durante a conversão.
- Referências:
6. É necessário ajustar a dose das polimixinas em pacientes com insuficiência renal?
Sim, para a Colistina. A dose de manutenção deve ser ajustada com base na função renal do paciente para evitar toxicidade. Para a Polimixina B, a maior parte da sua eliminação não é renal, então o ajuste de dose em pacientes com doença renal não é recomendado, o que simplifica seu uso nesse cenário.
- Referências:
7. O que é e por que a dose de ataque é tão importante?
A dose de ataque (ou dose de carga) é uma dose inicial mais alta administrada para atingir rapidamente a concentração terapêutica do antibiótico no sangue. É fundamental no uso de polimixinas, especialmente da Colistina, para superar a lenta conversão do pró-fármaco e garantir um efeito bactericida rápido em infecções graves.
- Referências:
8. Além da nefrotoxicidade, quais são os outros efeitos adversos importantes?
A neurotoxicidade é outro efeito adverso significativo, que pode se manifestar como tontura, fraqueza muscular, parestesias (formigamento) e, em casos graves, bloqueio neuromuscular e parada respiratória. Assim como na nefrotoxicidade, a Colistina parece apresentar um risco ligeiramente maior de neurotoxicidade.
- Referências:
9. Como os mecanismos de resistência às polimixinas funcionam?
O principal mecanismo de resistência envolve a modificação da molécula de lipopolissacarídeo (LPS) na membrana externa da bactéria. Essa alteração reduz a carga negativa da membrana, diminuindo a afinidade de ligação das polimixinas e impedindo sua ação. Essa resistência pode ser cromossômica ou, mais preocupante, mediada por plasmídeos (como o gene mcr), o que permite sua rápida disseminação entre diferentes bactérias.
- Referências:
10. A terapia combinada com polimixinas é superior à monoterapia?
Ainda há um debate intenso sobre isso. Estudos in vitro e alguns estudos clínicos retrospectivos sugerem que a combinação de polimixinas com outros antibióticos (como carbapenêmicos ou rifampicina) pode ter um efeito sinérgico e prevenir o surgimento de resistência. No entanto, grandes ensaios clínicos randomizados ainda são necessários para confirmar essa superioridade na prática clínica.
- Referências:
11. Qual o espectro de ação das polimixinas?
Elas são ativas quase exclusivamente contra bacilos Gram-negativos, incluindo Pseudomonas aeruginosa, Acinetobacter baumannii, Klebsiella pneumoniae, Escherichia coli e Enterobacter spp. Elas não têm atividade contra bactérias Gram-positivas, anaeróbios e alguns Gram-negativos como Proteus spp., Providencia spp., Morganella morganii e Serratia marcescens.
- Referências:
12. Como deve ser feita a diluição e administração da Polimixina B?
A bula da Polimixina B recomenda a diluição em grandes volumes (300 a 500 mL de soro glicosado 5%) para infusão contínua. Isso pode ser um problema para pacientes com restrição de volume. A administração em volumes menores e em infusões mais curtas é uma prática comum, mas deve ser feita com cautela e monitoramento.
- Referências:
13. A monitorização dos níveis séricos de polimixinas é recomendada?
Sim, a monitorização terapêutica de fármacos (TDM) é fortemente recomendada, especialmente para a Colistina, devido à sua farmacocinética imprevisível. A TDM ajuda a garantir que os níveis do medicamento estejam dentro da janela terapêutica, otimizando a eficácia e minimizando o risco de toxicidade.
14. Qual o papel da CCIH na gestão do uso de polimixinas?
A Comissão de Controle de Infecção Hospitalar (CCIH) tem um papel central. Ela deve desenvolver protocolos institucionais para o uso racional de polimixinas, promover a educação contínua sobre suas indicações e riscos, monitorar os dados de sensibilidade locais e auditar a prescrição para garantir que estão sendo usadas como terapia de último recurso e de forma otimizada.
15. Qual a dose recomendada de Polimixina B para adultos?
A dose recomendada, segundo diretrizes internacionais, inclui uma dose de ataque de 2,0 a 2,5 mg/kg (baseado no peso corporal total), seguida por uma dose de manutenção de 1,25 a 1,5 mg/kg a cada 12 horas.
- Referências:
16. As polimixinas podem ser usadas de forma inalatória?
Sim, a Colistina na forma de CMS é frequentemente usada de forma inalatória como terapia adjuvante para pneumonias associadas à ventilação mecânica (PAV) causadas por bacilos Gram-negativos multirresistentes. A ideia é entregar altas concentrações do fármaco diretamente no local da infecção, com menor toxicidade sistêmica.
17. O que é heterorresistência e por que é uma preocupação com as polimixinas?
Heterorresistência é a presença de uma subpopulação de bactérias resistentes dentro de uma população aparentemente sensível. Essa subpopulação pode crescer durante o tratamento com polimixinas, levando à falha terapêutica. A terapia combinada é uma das estratégias estudadas para suprimir essas subpopulações resistentes.
- Referências:
18. Qual a importância de conhecer o perfil de sensibilidade local para o uso de polimixinas?
É crucial. O uso empírico de polimixinas só deve ser considerado em hospitais com alta prevalência de infecções por bactérias resistentes a carbapenêmicos e sensíveis às polimixinas. Conhecer o perfil epidemiológico local, fornecido pela CCIH e pelo laboratório de microbiologia, guia decisões terapêuticas mais seguras e eficazes.
19. Existem novas drogas que podem substituir as polimixinas?
Sim. Novos antibióticos como o Cefiderocol e combinações de beta-lactâmicos com inibidores de beta-lactamase (ex: Ceftazidima-avibactam, Meropenem-vaborbactam) surgiram como alternativas mais seguras e, em muitos casos, mais eficazes para o tratamento de infecções por Gram-negativos multirresistentes. O papel das polimixinas está sendo redefinido, sendo cada vez mais reservadas para situações onde não há outras opções.
- Referências:
20. Qual a mensagem final para a prática clínica sobre a escolha entre Polimixina B e Colistina?
A escolha deve ser baseada no sítio da infecção e na função renal do paciente. Para infecções sistêmicas, a Polimixina B é a droga de escolha devido à sua farmacocinética superior e perfil de toxicidade potencialmente melhor. Para infecções urinárias, a Colistina é preferível. Em todos os casos, o uso deve ser criterioso, guiado por protocolos institucionais e com monitoramento rigoroso para minimizar os riscos.
- Referências:
Polimixinas na Era da Multirresistência: Uma Análise Crítica Comparativa entre Polimixina B e Colistina para a Prática Clínica
I. Introdução: O Renascimento das Polimixinas como Último Recurso Terapêutico
A medicina moderna enfrenta um de seus maiores desafios: a ascensão de bactérias Gram-negativas multirresistentes (MDR), que transformaram infecções antes tratáveis em ameaças existenciais à saúde global (Ref. 1, 2). Patógenos como Acinetobacter baumannii resistente a carbapenêmicos (CRAB), Pseudomonas aeruginosa e Enterobacterales produtoras de carbapenemases (CPE) tornaram-se endêmicos em ambientes hospitalares, especialmente em Unidades de Terapia Intensiva (UTIs), deixando os clínicos com um arsenal terapêutico perigosamente esgotado (Ref. 3, 4). Neste cenário de urgência, assistimos ao renascimento das polimixinas, uma classe de antibióticos descoberta em 1947 e largamente abandonada nos anos 1970 e 1980 devido à sua notória toxicidade, em favor de agentes mais seguros que surgiram na época (Ref. 5, 6).
O retorno da Polimixina B e da Colistina (Polimixina E) não é uma celebração de inovação, mas uma medida de necessidade, impulsionada pelo vácuo no desenvolvimento de novos antimicrobianos eficazes contra estas “superbactérias” (Ref. 7, 8). Embora ambas compartilhem um espectro de ação semelhante, diferenças farmacológicas fundamentais entre elas criam um dilema clínico complexo. A escolha entre Polimixina B e Colistina para o tratamento de uma infecção hospitalar grave não é trivial e exige uma compreensão aprofundada de suas distintas propriedades farmacocinéticas, perfis de toxicidade e evidências clínicas. Este artigo se propõe a realizar uma análise crítica e comparativa, dissecando as evidências que devem guiar a decisão clínica, com o objetivo de otimizar a eficácia e minimizar os riscos associados ao uso destes agentes de último recurso.
II. Fundamentos Farmacológicos: As Diferenças Estruturais que Definem a Prática Clínica
Apesar de sua estrutura química similar — ambas são polipeptídeos cíclicos lipofílicos que diferem por apenas um aminoácido — as implicações clínicas da Polimixina B e da Colistina divergem drasticamente a partir do momento de sua administração (Ref. 9).
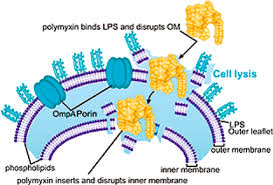
Mecanismo de Ação Comum
Ambos os fármacos exercem sua potente atividade bactericida através do mesmo mecanismo. Sendo policationicas em pH fisiológico, elas interagem com o lipopolissacarídeo (LPS) da membrana externa das bactérias Gram-negativas. Essa interação desestabiliza os íons de cálcio e magnésio que mantêm a integridade do LPS, resultando em um aumento da permeabilidade da membrana. A porção lipofílica do antibiótico então se insere na membrana, desorganizando sua estrutura de forma análoga a um detergente, o que leva ao extravasamento do conteúdo celular e à morte bacteriana rápida (Ref. 10, 11).
A Divergência Crucial: Pró-fármaco vs. Fármaco Ativo
A diferença mais crítica, que fundamenta toda a discussão comparativa, reside na forma como são administradas. A Polimixina B é administrada por via intravenosa em sua forma ativa, o sulfato de polimixina B. Isso garante que as concentrações plasmáticas terapêuticas sejam atingidas de forma rápida e previsível (Ref. 12, 13).
Em contrapartida, a Colistina é administrada como um pró-fármaco inativo, o colistimetato de sódio (CMS). O CMS precisa ser convertido in vivo para a forma ativa, a colistina. Este processo de conversão é lento, incompleto e apresenta uma enorme variabilidade interindividual (Ref. 9, 14, 15). Estudos demonstram que apenas uma fração do CMS administrado (cerca de 30% a 60%) é convertida em colistina ativa, e o tempo para atingir o pico de concentração pode levar horas ou até dias, especialmente no início da terapia (Ref. 16, 17). Essa imprevisibilidade farmacocinética é um dos maiores desafios no uso da colistina.
Implicações Farmacocinéticas (PK) e Farmacodinâmicas (PD)
As polimixinas são antibióticos com atividade concentração-dependente, cujo principal índice de eficácia é a razão entre a área sob a curva de concentração plasmática da fração livre do fármaco e a concentração inibitória mínima (fAUC/MIC) (Ref. 18). A rápida obtenção de uma exposição adequada é, portanto, crucial para a erradicação do patógeno e para minimizar a seleção de resistência.
O perfil da Polimixina B, como fármaco ativo, é muito mais favorável para atingir rapidamente este alvo. Modelos in vitro demonstram que regimes de dosagem de Polimixina B atingem concentrações bactericidas em 1 hora, enquanto a lenta conversão do CMS resulta em uma atividade bactericida marcadamente reduzida nas fases iniciais críticas do tratamento (Ref. 19). O risco de concentrações subterapêuticas iniciais com o uso de colistina é uma preocupação real, podendo levar à falha terapêutica e à amplificação de populações bacterianas resistentes (Ref. 17, 19).
Clearance e Ajuste Renal
As vias de eliminação dos dois fármacos são notavelmente distintas e têm implicações diretas na dosagem. A Polimixina B é eliminada predominantemente por vias não renais, com menos de 5% da dose sendo recuperada de forma inalterada na urina (Ref. 20). Estudos farmacocinéticos populacionais em pacientes críticos demonstraram de forma conclusiva que o clearance da Polimixina B não se correlaciona com a função renal (Ref. 13). Portanto, sua dosagem deve ser baseada no peso corporal total do paciente, sem necessidade de ajuste para disfunção renal, uma vantagem operacional significativa em pacientes de UTI com função renal frequentemente instável.
A farmacocinética da Colistina é mais complexa. O pró-fármaco CMS é primariamente eliminado pelos rins. Em pacientes com função renal normal, uma grande proporção do CMS é excretada na urina antes que possa ser convertida na colistina ativa, resultando em baixas concentrações sistêmicas do fármaco ativo (Ref. 16, 21). Paradoxalmente, em pacientes com insuficiência renal, a eliminação do CMS diminui, permitindo que uma fração maior seja convertida em colistina, levando a concentrações plasmáticas mais elevadas e, consequentemente, a um maior risco de toxicidade. Isso torna obrigatório o ajuste de dose do CMS com base na depuração de creatinina (Ref. 22).
A Tabela 1 resume as principais diferenças farmacológicas entre os dois agentes.
Tabela 1: Comparativo Farmacocinético e Farmacodinâmico: Polimixina B vs. Colistina
| Característica | Polimixina B | Colistina (administrada como CMS) |
| Forma de Administração | Fármaco ativo (Sulfato de Polimixina B) | Pró-fármaco inativo (Colistimetato de Sódio) |
| Conversão in vivo | Não aplicável | Lenta, incompleta e altamente variável |
| Tempo para Atingir Concentração Terapêutica | Rápido (minutos a horas) | Lento (horas a dias) |
| Previsibilidade da Exposição Plasmática | Alta | Baixa |
| Principal Via de Clearance | Não-renal | Renal (para o pró-fármaco CMS) |
| Necessidade de Ajuste por Função Renal | Não | Sim (mandatório) |
| Vantagem Clínica Primária | Infecções sistêmicas (ex: bacteremia) | Infecções do trato urinário |
III. O Dilema da Nefrotoxicidade: Análise Crítica das Evidências Atuais
A nefrotoxicidade é o efeito adverso mais comum e dose-limitante das polimixinas, sendo uma preocupação central na decisão clínica (Ref. 23). O debate sobre qual dos dois agentes é mais seguro para os rins é intenso e a literatura, por vezes, contraditória.
Mecanismo da Lesão Renal
O mecanismo de toxicidade renal é o mesmo para ambos os fármacos. As polimixinas são extensivamente reabsorvidas nos túbulos renais proximais, onde se acumulam em altas concentrações dentro das células epiteliais. Essa alta concentração intracelular leva à citotoxicidade direta, estresse oxidativo e disfunção mitocondrial, culminando em necrose tubular aguda e desenvolvimento de Lesão Renal Aguda (LRA) (Ref. 9). A questão não é se elas são nefrotóxicas, mas se existe uma diferença clinicamente relevante em seu potencial de causar LRA.
Revisão das Meta-análises
Diversas revisões sistemáticas e meta-análises tentaram responder a essa pergunta. Um estudo abrangente conduzido por Oliota et al., que incluiu 95 coortes e mais de 7.900 pacientes, encontrou prevalências de nefrotoxicidade muito semelhantes: 29,8% para a Polimixina B e 26,7% para a Colistina, sem diferença estatisticamente significativa (p=0,720) (Ref. 24, 25). Este achado sugere que, em uma análise global, ambos os fármacos apresentam um risco substancial e comparável de LRA.
No entanto, outras análises chegaram a conclusões diferentes. Uma meta-análise de Elias et al. reportou que a nefrotoxicidade não ajustada foi mais comum em pacientes tratados com colistina do que com Polimixina B (Risk Ratio = 1,55; IC 95% 1,36-1,78) e que a LRA ocorria mais precocemente com a colistina (Ref. 26).
A Importância da Metodologia e da Previsibilidade
A discrepância entre os estudos pode ser explicada por diferenças metodológicas. A pesquisa de Oliota destacou que a incidência de nefrotoxicidade era frequentemente subestimada em estudos mais antigos, naqueles que usavam apenas a creatinina sérica como critério (em vez de classificações padronizadas como RIFLE ou AKIN), e quando a LRA era um desfecho secundário (Ref. 25). A falta de padronização nos relatos é uma limitação significativa da literatura.
Contudo, a discussão deve ir além das taxas de prevalência bruta e focar na previsibilidade e controlabilidade do risco. A farmacocinética da colistina, com sua conversão imprevisível, torna o risco de nefrotoxicidade menos gerenciável. Em um paciente crítico com função renal flutuante, a exposição à colistina ativa pode variar enormemente, levando a picos de concentração inesperados e tóxicos. Em contraste, a exposição à Polimixina B é diretamente proporcional à dose administrada, tornando o risco de toxicidade uma variável conhecida e mais controlável (Ref. 9, 13). A vantagem clínica da Polimixina B pode não ser uma menor taxa média de LRA, mas sim um menor risco de toxicidade imprevisível, um atributo de valor inestimável no cuidado intensivo.
IV. Otimização da Terapia: Diretrizes Modernas de Dosagem e Monitoramento
O conhecimento farmacocinético adquirido nas últimas duas décadas revolucionou a forma como as polimixinas devem ser dosadas, abandonando os regimes antigos e sub-ótimos. As diretrizes de consenso internacional fornecem recomendações claras para maximizar a eficácia e minimizar a toxicidade (Ref. 27).
A Importância da Dose de Ataque
Para antibióticos concentração-dependentes, atingir rapidamente o alvo terapêutico é fundamental. Por isso, uma dose de ataque (loading dose) é fortemente recomendada tanto para a Polimixina B quanto para a Colistina, especialmente em pacientes com infecções graves (Ref. 13, 17, 27). A dose de ataque satura o volume de distribuição do fármaco, permitindo que as doses de manutenção subsequentes mantenham a concentração plasmática dentro da janela terapêutica.
Dosagem da Polimixina B
A dosagem da Polimixina B é mais direta, baseada no peso corporal total (PCT) e independente da função renal (Ref. 13):
- Dose de Ataque: 2,0 a 2,5 mg/kg de PCT, infundida em 1 hora.
- Dose de Manutenção: 1,25 a 1,5 mg/kg de PCT a cada 12 horas, infundida em 1 hora.
- Ajuste Renal: Não é necessário.
Dosagem da Colistina (CMS)
A dosagem do CMS é mais complexa e exige cálculo da depuração de creatinina (CrCl):
- Dose de Ataque: Recomenda-se uma dose de 300 mg de atividade de colistina base (CBA), o que equivale a aproximadamente 9 milhões de unidades internacionais (UI), infundida em 0,5 a 1 hora (Ref. 27).
- Dose de Manutenção: A primeira dose de manutenção deve ser administrada 12 a 24 horas após a dose de ataque. A dose diária total deve ser ajustada rigorosamente com base na CrCl do paciente e dividida em duas administrações.
- Ajuste para Terapias de Substituição Renal (TSR): Pacientes em TSR contínua ou intermitente necessitam de doses suplementares específicas para compensar a remoção do fármaco (Ref. 22, 27).
A Tabela 2, adaptada das diretrizes de consenso internacional, ilustra a complexidade do ajuste de dose do CMS e a simplicidade da Polimixina B (Ref. 27).
Tabela 2: Recomendações de Dosagem Intravenosa para Polimixinas em Adultos Criticamente Enfermos
| Fármaco | Dose de Ataque | Dose de Manutenção | Comentário Chave |
| Polimixina B | 2,0-2,5 mg/kg (PCT) | 1,25-1,5 mg/kg (PCT) a cada 12h | NÃO ajustar para função renal. |
| Colistina (CMS) | 300 mg CBA (~9 milhões UI) | Ajustada pela função renal (ver sub-tabela) | Ajuste MANDATÓRIO pela CrCl. |
| Sub-tabela: Dose de Manutenção Diária de CMS (CBA) | |||
| CrCl (mL/min) | Dose Diária (mg CBA) | Dose Diária (Milhões UI) | |
| 360 mg | 10,9 M UI | ||
| 80 a < 90 | 340 mg | 10,3 M UI | |
| 70 a < 80 | 300 mg | 9,0 M UI | |
| 60 a < 70 | 275 mg | 8,35 M UI | |
| 50 a < 60 | 245 mg | 7,40 M UI | |
| 40 a < 50 | 220 mg | 6,65 M UI | |
| 30 a < 40 | 195 mg | 5,90 M UI | |
| 20 a < 30 | 175 mg | 5,30 M UI | |
| 10 a < 20 | 160 mg | 4,85 M UI | |
| 5 a < 10 | 145 mg | 4,40 M UI | |
| 0 | 130 mg | 3,95 M UI |
V. Evidências Clínicas e Recomendações por Sítio de Infecção
A aplicação dos princípios farmacológicos varia conforme o cenário clínico, e as diretrizes de especialistas refletem essa nuance.
Infecções Sistêmicas (Bacteremia, Sepse)
Para infecções graves da corrente sanguínea, a rápida obtenção de concentrações bactericidas é de suma importância. O perfil farmacocinético superior da Polimixina B — com sua administração na forma ativa e níveis plasmáticos rápidos e previsíveis — a torna a escolha teórica e clinicamente preferencial (Ref. 28). Embora estudos retrospectivos não tenham consistentemente demonstrado uma diferença na mortalidade (Ref. 26, 29, 28), o robusto racional farmacológico para uma terapia mais confiável em um paciente séptico favorece fortemente a Polimixina B.
Infecções por Acinetobacter baumannii Resistente a Carbapenêmicos (CRAB)
As diretrizes de 2024 da Infectious Diseases Society of America (IDSA) para o tratamento de infecções por CRAB são explícitas. O painel de especialistas sugere a Polimixina B (em combinação com outro agente) como a polimixina de escolha, citando especificamente seu perfil farmacocinético mais favorável em comparação com a colistina (Ref. 30). Esta é uma forte recomendação de uma das mais influentes sociedades de doenças infecciosas do mundo.
Infecções do Trato Urinário (ITU)
Este é o nicho clínico onde a Colistina mantém uma vantagem. Como o pró-fármaco CMS é excretado e convertido em colistina ativa no trato urinário, ele atinge altas concentrações locais, o que é ideal para o tratamento de ITUs causadas por patógenos MDR (Ref. 28, 30). Em contraste, a excreção urinária de Polimixina B ativa é mínima, tornando-a uma opção inferior para este sítio de infecção.
Pneumonia / Infecções Respiratórias
O tratamento de pneumonias com polimixinas intravenosas é desafiador, pois a penetração de ambos os fármacos no fluido de revestimento epitelial dos pulmões é baixa (Ref. 17). Isso levanta questões sobre a eficácia da monoterapia intravenosa. O uso adjunto de polimixinas inalatórias é uma prática em alguns centros, mas sua eficácia e segurança ainda são objeto de debate e requerem mais estudos.
VI. Além da Nefrotoxicidade: Outros Eventos Adversos e Limitações
Embora a nefrotoxicidade domine a discussão, outros riscos e limitações devem ser considerados para um manejo seguro do paciente.
Neurotoxicidade
A neurotoxicidade é o segundo efeito adverso mais comum, também dose-dependente. As manifestações podem incluir parestesias periorais e de extremidades, tontura, ataxia, fraqueza muscular e, em casos graves, bloqueio neuromuscular e parada respiratória (Ref. 31, 11). A vigilância dos sintomas neurológicos é essencial durante a terapia.
Outros Eventos Adversos
Reações mais raras, mas potencialmente graves, foram relatadas. Casos de hipersensibilidade, incluindo choque anafilático, exigem descontinuação imediata e tratamento de suporte (Ref. 32). Leucopenia, uma reação hematológica rara, também foi descrita, reforçando a necessidade de monitoramento laboratorial (Ref. 33). A hiperpigmentação cutânea é outro efeito adverso notado, principalmente com a Polimixina B (Ref. 33).
A Ameaça da Resistência
A eficácia das polimixinas está ameaçada pelo surgimento de resistência. Historicamente, a resistência era mediada por mutações cromossômicas que levavam à modificação do LPS, alterando sua carga e diminuindo a afinidade de ligação do antibiótico (Ref. 34, 35). No entanto, um desenvolvimento alarmante foi a descoberta em 2015 do primeiro gene de resistência a polimixinas mediado por plasmídeo, o mcr-1 (Ref. 36).
Os genes da família mcr codificam enzimas que modificam o LPS, conferindo resistência, e sua localização em plasmídeos permite a transferência horizontal rápida entre diferentes espécies e cepas de bactérias (Ref. 37, 38). Este mecanismo representa uma ameaça de saúde pública global. A escolha de um agente com farmacocinética mais previsível, como a Polimixina B, torna-se também uma estratégia de antimicrobial stewardship. Ao minimizar o risco de exposição a concentrações subterapêuticas — um conhecido fator de seleção para resistência — a preferência pela Polimixina B pode ajudar a diminuir a pressão seletiva que acelera a disseminação de genes mcr, preservando a utilidade desta classe de antibióticos de último recurso.
VII. Conclusões e Perspectivas: Navegando o Uso das Polimixinas com Precisão e Cuidado
As polimixinas são armas indispensáveis, ainda que imperfeitas, na luta contra as infecções por bactérias Gram-negativas multirresistentes. A decisão entre Polimixina B e Colistina, longe de ser uma questão de preferência pessoal, deve ser fundamentada em uma sólida compreensão de suas diferenças farmacológicas.
As evidências acumuladas na última década apontam para uma conclusão clara: para o tratamento de infecções sistêmicas graves, a Polimixina B deve ser considerada a polimixina de escolha. Seu perfil farmacocinético superior — administração na forma ativa, obtenção rápida de níveis terapêuticos e dosagem previsível baseada no peso, sem a necessidade de ajuste renal — oferece vantagens significativas em termos de confiabilidade e segurança operacional no manejo de pacientes críticos. Esta recomendação é corroborada por diretrizes de especialistas, como as da IDSA para infecções por CRAB. A Colistina, por sua vez, mantém seu valor como um agente de nicho, primariamente para o tratamento de infecções do trato urinário.
O renascimento das polimixinas nos lembra que a farmacologia não é uma ciência estática. A aplicação de princípios farmacocinéticos e farmacodinâmicos modernos a fármacos antigos permitiu otimizar seu uso de uma forma que era impossível na época de sua descoberta. O uso criterioso destes agentes, guiado por diretrizes baseadas em evidências e um compromisso inabalável com o antimicrobial stewardship, é nossa melhor estratégia para garantir que esta última linha de defesa permaneça eficaz para os pacientes que mais precisam, hoje e no futuro.
As polimixinas são o último bastião na guerra contra as bactérias Gram-negativas multirresistentes. No entanto, tratá-las como equivalentes é um erro que pode custar caro.
A Polimixina B emerge como a melhor opção para infecções sistêmicas graves: é um fármaco ativo, com farmacocinética previsível, rápida obtenção de níveis terapêuticos e independência da função renal, o que simplifica a dosagem em pacientes críticos. A Colistina, por outro lado, continua relevante para infecções urinárias, onde sua conversão local em colistina ativa é vantajosa.
Mais do que um debate técnico, a escolha entre esses fármacos é um ato de antimicrobial stewardship: usar o conhecimento farmacológico para otimizar eficácia, reduzir toxicidade e frear a evolução da resistência.
No fim, o renascimento das polimixinas é um lembrete de que a ciência clínica de precisão é nossa arma mais poderosa contra a multirresistência.
VIII. Referências Bibliográficas Comentadas
- OLIOTA, Ana Flavia Redolfi. Avaliação da nefrotoxicidade de colistina e polimixina B no manejo de infecções por bactérias multirresistentes: uma revisão sistemática com meta-análise. Dissertação (Mestrado em Ciências Farmacêuticas) – Universidade Estadual do Oeste do Paraná, Cascavel, 2018. Disponível em: https://tede.unioeste.br/handle/tede/3650.
- Resumo: Esta dissertação apresenta uma meta-análise robusta que comparou a prevalência de nefrotoxicidade entre colistina e polimixina B. O estudo concluiu que não há diferença estatisticamente significativa entre os dois fármacos, mas criticamente apontou para a subestimação da toxicidade em estudos mais antigos e com metodologias menos padronizadas.
- WORLD HEALTH ORGANIZATION (WHO). Global priority list of antibiotic-resistant bacteria to guide research, discovery, and development of new antibiotics. Geneva: WHO, 2017. Disponível em: https://www.who.int/news/item/27-02-2017-who-publishes-list-of-bacteria-for-which-new-antibiotics-are-urgently-needed.
- Resumo: Documento fundamental da OMS que classifica os patógenos resistentes a antibióticos por nível de prioridade, colocando Acinetobacter baumannii e Pseudomonas aeruginosa resistentes a carbapenêmicos na categoria crítica, justificando a necessidade de agentes como as polimixinas.
- INSTITUTO CCIH+. Controle de infecções por Acinetobacter baumannii resistente a carbapenêmicos. CCIH Cursos, 2024. Disponível em: https://www.ccih.med.br/controle-de-infeccoes-por-acinetobacter-baumannii-resistente-a-carbapenemicos/.
- Resumo: Artigo do portal CCIH.med.br que contextualiza a problemática do CRAB no ambiente hospitalar, discutindo sua epidemiologia, transmissão e os desafios terapêuticos, o que estabelece o cenário para o uso das polimixinas.
- INSTITUTO CCIH+. Resistência aos carbapenêmicos: o desafio crítico da infectologia moderna. CCIH Cursos, 2023. Disponível em: https://www.ccih.med.br/resistencia-aos-carbapenemicos-o-desafio-critico-da-infectologia-moderna/.
- Resumo: Análise aprofundada sobre a resistência aos carbapenêmicos, explicando os mecanismos e o impacto clínico. O artigo reforça por que os carbapenêmicos, antes considerados a última linha, falham, tornando as polimixinas essenciais.
- VAARA, M. The old polymyxins. Frontiers in Microbiology, v. 10, p. 1689, 2019. DOI: https://doi.org/10.3389/fmicb.2019.01689.
- Resumo: Uma revisão histórica sobre a descoberta e o desenvolvimento inicial das polimixinas. O artigo detalha por que esses fármacos foram abandonados e contextualiza seu recente ressurgimento no cenário de resistência antimicrobiana.
- KAYE, K. S. et al. The re-emergence of polymyxins for the treatment of multi-drug resistant Gram-negative bacterial infections. Current Opinion in Infectious Diseases, v. 37, n. 6, p. 555-562, 2024. https://journals.lww.com/co-infectiousdiseases/pages/default.aspx
- Resumo: Este artigo de revisão discute o papel contemporâneo das polimixinas, abordando os desafios clínicos, incluindo dosagem e toxicidade, no tratamento de infecções por bactérias MDR.
- ZAVASCKI, A. P.; NATION, R. L. Polymyxin B for the treatment of multidrug-resistant pathogens: a critical review. Journal of Antimicrobial Chemotherapy, v. 60, n. 6, p. 1206-1215, 2007. DOI: https://doi.org/10.1093/jac/dkm357.
- Resumo: Uma revisão CLÁSSICA que, já em 2007, destacava a Polimixina B como uma opção terapêutica crucial. O artigo revisa dados microbiológicos, farmacocinéticos e clínicos, sublinhando a necessidade de otimizar os regimes de dosagem.
- FALAGAS, M. E. et al. The revival of polymyxins for the treatment of multidrug-resistant Gram-negative bacterial infections. The Lancet Infectious Diseases, v. 5, n. 12, p. 737-746, 2005. DOI: https://doi.org/10.1016/S1473-3099(05)70287-X.
- Resumo: Um dos primeiros artigos influentes a documentar o “renascimento” das polimixinas, discutindo as evidências para seu uso contra patógenos como P. aeruginosa, A. baumannii e K. pneumoniae.
- NANG, S. C.; AZAD, M. A. K.; VELKOV, T.; ZHAO, J.; LI, J.; NATION, R. L. Nephrotoxicity of the polymyxins: is there any difference between colistin and polymyxin B? Antimicrobial Agents and Chemotherapy, v. 61, n. 4, e02319-16, 2017. DOI: https://doi.org/10.1128/AAC.02319-16.
- Resumo: Revisão fundamental que explora em profundidade as diferenças farmacocinéticas e os mecanismos de manuseio renal entre a colistina (CMS) e a Polimixina B, fornecendo o racional farmacológico para as diferenças observadas na nefrotoxicidade.
- TRIMBLE, M. J. et al. The polymyxins: a review of the current evidence. Pharmacotherapy, v. 36, n. 10, p. 1117-1134, 2016. DOI: https://doi.org/10.1002/phar.1830.
- Resumo: Revisão abrangente que detalha o mecanismo de ação das polimixinas, sua atividade contra patógenos MDR e as controvérsias em torno de sua dosagem e monitoramento.
- PO-REN, H. et al. Polymyxins: Antimicrobial susceptibility, resistance mechanism, and disk diffusion testing. Journal of Microbiology, Immunology and Infection, v. 52, n. 3, p. 377-388, 2019. DOI: https://doi.org/10.1016/j.jmii.2019.04.004.
- Resumo: Este artigo foca nos aspectos microbiológicos das polimixinas, incluindo os mecanismos de ação e resistência, e os desafios associados aos testes de sensibilidade no laboratório clínico.
- RODRÍGUEZ, C. H. et al. Polymyxin B versus colistin for the treatment of bloodstream infections caused by carbapenem-resistant Acinetobacter baumannii and Pseudomonas aeruginosa. Antibiotics, v. 12, n. 8, p. 1317, 2023. DOI: https://doi.org/10.3390/antibiotics12081317.
- Resumo: Estudo retrospectivo comparando desfechos clínicos (mortalidade e nefrotoxicidade) entre Polimixina B e colistina em pacientes com bacteremia. Não encontrou diferença estatística na mortalidade, mas reforça a discussão sobre a escolha do agente.
- SANDRI, A. M. et al. Pharmacokinetics of intravenous polymyxin B in critically ill patients. Clinical Infectious Diseases, v. 57, n. 4, p. 524-531, 2013. DOI: https://doi.org/10.1093/cid/cit337.
- Resumo: Estudo farmacocinético populacional seminal em 24 pacientes críticos que demonstrou que o clearance da Polimixina B é predominantemente não-renal e não se correlaciona com a depuração de creatinina. Fundamenta a recomendação de dosagem baseada no peso, independentemente da função renal.
- COULTHARD, C. E.; SHORT, E. I. Intramuscular injection of colistin methane sulphonate. The Lancet, v. 278, n. 7212, p. 1108-1109, 1961. DOI: https://doi.org/10.1016/S0140-6736(61)91018-0.
- Resumo: Um dos primeiros estudos históricos que descreveu a farmacocinética do CMS, já notando sua excreção renal e a lenta aparição da atividade antibacteriana, prenunciando as complexidades do pró-fármaco.
- BERGEN, P. J. et al. Colistin methanesulfonate is an inactive prodrug of colistin against Pseudomonas aeruginosa. Antimicrobial Agents and Chemotherapy, v. 50, n. 6, p. 1953-1958, 2006. DOI: https://doi.org/10.1128/AAC.00035-06.
- Resumo: Estudo chave que confirmou inequivocamente que o CMS é um pró-fármaco inativo, com conversão lenta para a forma ativa, a colistina. Este trabalho foi fundamental para reavaliar os regimes de dosagem.
- GOU, J. et al. A comprehensive review on the pharmacokinetics of colistimethate sodium (CMS) and colistin in critically ill patients. Pharmaceutics, v. 14, n. 9, p. 903, 2021. DOI: https://doi.org/10.3390/pharmaceutics14090903.
- Resumo: Revisão sistemática que compila e analisa os dados farmacocinéticos de múltiplos estudos sobre CMS e colistina em pacientes críticos, destacando a alta variabilidade e a complexidade na otimização da dose.
- DUDHIA, Z. et al. In vitro pharmacodynamics of colistin against Acinetobacter baumannii. Journal of Antimicrobial Chemotherapy, v. 66, n. 3, p. 559-565, 2011. DOI: https://doi.org/10.1093/jac/dkq489.
- Resumo: Estudo farmacodinâmico que demonstra a importância de atingir rapidamente concentrações terapêuticas de colistina para uma atividade bactericida eficaz, apoiando o uso de doses de ataque.
- CHEAH, S. E. et al. Development and validation of a liquid chromatography-tandem mass spectrometry assay for the quantification of polymyxin B in human plasma. Journal of Chromatography B, v. 960, p. 204-210, 2014. DOI: https://doi.org/10.1016/j.jchromb.2014.04.038.
- Resumo: Este artigo técnico descreve um método analítico para medir a Polimixina B, essencial para os estudos farmacocinéticos modernos que definiram os parâmetros de AUC/MIC como alvo terapêutico.
- BERGEN, P. J. et al. A novel pharmacodynamic model for polymyxin B against Acinetobacter baumannii. Antimicrobial Agents and Chemotherapy, v. 60, n. 1, p. 157-164, 2016. DOI: https://doi.org/10.1128/AAC.02927-15.
- Resumo: Um estudo in vitro que utilizou um modelo dinâmico para comparar a atividade bactericida da Polimixina B e da colistina, demonstrando a superioridade da Polimixina B em alcançar uma morte bacteriana rápida devido à sua farmacocinética mais favorável.
- ZAVASCKI, A. P. et al. Renal clearance of polymyxin B in patients with normal renal function. Antimicrobial Agents and Chemotherapy, v. 52, n. 3, p. 1144-1145, 2008. DOI: https://doi.org/10.1128/AAC.01321-07.
- Resumo: Um estudo focado na eliminação da Polimixina B que confirmou sua baixa excreção renal, um dos pilares para a recomendação de não ajustar a dose em pacientes com insuficiência renal.
- PLACHOURAS, D. et al. Population pharmacokinetic analysis of colistin methanesulfonate and colistin after intravenous administration in critically ill patients with varying renal function. Antimicrobial Agents and Chemotherapy, v. 53, n. 8, p. 3430-3436, 2009. DOI: https://doi.org/10.1128/AAC.01361-08.
- Resumo: Análise farmacocinética populacional que modelou a complexa relação entre a função renal, a eliminação do CMS e a formação de colistina, fornecendo a base para os nomogramas de ajuste de dose.
- GARONZIK, S. M. et al. Population pharmacokinetics of colistin methanesulfonate and formed colistin in critically ill patients. Antimicrobial Agents and Chemotherapy, v. 55, n. 7, p. 3284-3294, 2011. DOI: https://doi.org/10.1128/AAC.01733-10.
- Resumo: Um dos estudos mais importantes sobre a farmacocinética da colistina em pacientes críticos, que desenvolveu algoritmos de dosagem para atingir concentrações-alvo com base na função renal e no peso corporal.
- MENDES, C. A. C.; BURDMANN, E. A. Polimixinas: revisão com ênfase na sua nefrotoxicidade. Revista da Associação Médica Brasileira, v. 55, n. 6, p. 752-759, 2009. DOI: https://doi.org/10.1590/S0104-42302009000600023.
- Resumo: Artigo de revisão em português que oferece uma visão geral sobre as polimixinas, com um foco especial nos mecanismos de nefrotoxicidade e na prevalência de lesão renal descrita na literatura até então.
- OLIOTA, A. F. R. et al. Prevalence of nephrotoxicity in patients treated with polymyxins: a systematic review with meta-analysis of cohort studies. Diagnostic Microbiology and Infectious Disease, v. 94, n. 1, p. 41-49, 2019. DOI: https://doi.org/10.1016/j.diagmicrobio.2018.11.011.
- Resumo: Publicação formal da meta-análise de Oliota, confirmando a prevalência similar de nefrotoxicidade entre colistina (26,7%) e Polimixina B (29,8%) e destacando fatores que influenciam a heterogeneidade dos resultados.
- OLIOTA, Ana Flavia Redolfi. Avaliação da nefrotoxicidade de colistina e polimixina B no manejo de infecções por bactérias multirresistentes: uma revisão sistemática com meta-análise. Cascavel, 2018.
- Resumo: A dissertação original que fornece detalhes metodológicos aprofundados sobre a meta-análise, incluindo a crítica sobre a subestimação da nefrotoxicidade em estudos com falhas metodológicas.
- ELIAS, L. S. et al. Colistin versus polymyxin B for the treatment of patients with multidrug-resistant Gram-negative infections: a systematic review and meta-analysis. International Journal of Antimicrobial Agents, v. 49, n. 4, p. 391-399, 2017. DOI: https://doi.org/10.1016/j.ijantimicag.2016.12.013.
- Resumo: Meta-análise que encontrou uma maior incidência de nefrotoxicidade com a colistina em comparação com a Polimixina B, contrastando com outros estudos e alimentando o debate sobre a segurança relativa dos dois fármacos.
- TSUJI, B. T. et al. International Consensus Guidelines for the Optimal Use of the Polymyxins: Endorsed by the American College of Clinical Pharmacy (ACCP), European Society of Clinical Microbiology and Infectious Diseases (ESCMID), Infectious Diseases Society of America (IDSA), International Society for Anti-infective Pharmacology (ISAP), Society of Critical Care Medicine (SCCM), and Society of Infectious Diseases Pharmacists (SIDP). Pharmacotherapy, v. 39, n. 1, p. 10-39, 2019. DOI: https://doi.org/10.1002/phar.2209.
- Resumo: Documento de consenso fundamental, elaborado por múltiplas sociedades internacionais, que estabelece as recomendações atuais para a dosagem e o monitoramento da Polimixina B e da colistina em adultos, incluindo o uso de doses de ataque.
- RODRÍGUEZ-BAÑO, J. et al. Treatment of infections caused by carbapenem-resistant Acinetobacter baumannii. Clinical Microbiology and Infection, v. 24, Suppl 1, S45-S51, 2018. DOI: https://doi.org/10.1016/j.cmi.2017.11.006.
- Resumo: Artigo de revisão que discute as opções terapêuticas para CRAB, já apontando para as vantagens farmacocinéticas da Polimixina B em infecções sistêmicas.
- DE OLIVEIRA, M. S. et al. Polymyxin B in combination versus polymyxin B in monotherapy in critically ill patients with sensitive Gram-negative infections. Journal of Infection, v. 72, n. 4, p. 444-452, 2016. DOI: https://doi.org/10.1016/j.jinf.2016.01.002.
- Resumo: Estudo clínico que avaliou a Polimixina B em monoterapia e em combinação, contribuindo para o corpo de evidências sobre seu uso em pacientes críticos, embora sem comparar diretamente com a colistina.
- INSTITUTO CCIH+. IDSA 2024: Acinetobacter resistente aos carbapenêmicos. CCIH Cursos, 2024. Disponível em: https://www.ccih.med.br/idsa-2024-acinetobacter-resistente-aos-carbapenemicos/.
- Resumo: Divulgação e comentário sobre as novas diretrizes da IDSA para o tratamento de CRAB, destacando a recomendação explícita pela Polimixina B devido ao seu perfil farmacocinético superior.
- SPIVAK, O. et al. Polymyxin B-related neurotoxicity: a brief case report. Journal of Clinical Pharmacy and Therapeutics, v. 48, n. 5, p. 696-698, 2023. DOI: https://doi.org/10.1111/jcpt.13840.
- Resumo: Relato de caso que exemplifica a neurotoxicidade associada à Polimixina B, servindo como um lembrete clínico da importância de monitorar os sintomas neurológicos durante o tratamento.
- LI, H. et al. Polymyxin B-induced anaphylactic shock: a case report. Frontiers in Pharmacology, v. 16, 1594127, 2025. DOI: https://doi.org/10.3389/fphar.2025.1594127.
- Resumo: Relato de um caso raro de choque anafilático induzido por Polimixina B, destacando a necessidade de vigilância para reações de hipersensibilidade, mesmo que incomuns.
- ZHANG, Y. et al. Polymyxin E-associated leukopenia: a case report and literature review. Infection Control & Hospital Epidemiology, p. 1-3, 2024. DOI: https://doi.org/10.1017/ice.2024.120.
- Resumo: Relato de caso que descreve a leucopenia como um evento adverso raro, mas provável, da colistina, ampliando o espectro de toxicidades conhecidas e a importância do monitoramento hematológico.
- OLaitan, A. O.; MORADIGARAVAND, D.; BERENDT, A. R.; CHAUDHURI, R. R.; THOMSON, N. R.; GIRAUD, E. Mechanisms of polymyxin resistance: acquired and intrinsic resistance in bacteria. Frontiers in Microbiology, v. 5, p. 643, 2014. DOI: https://doi.org/10.3389/fmicb.2014.00643.
- Resumo: Revisão detalhada sobre os mecanismos de resistência às polimixinas, explicando as modificações no LPS mediadas por mutações cromossômicas, que constituem a base da resistência adquirida.
- MOFFATT, J. H. et al. Lipopolysaccharide modification in Gram-negative bacteria: a major mechanism of polymyxin resistance. Current Opinion in Microbiology, v. 13, n. 5, p. 578-584, 2010. DOI: https://doi.org/10.1016/j.mib.2010.07.012.
- Resumo: Artigo focado no principal mecanismo de resistência cromossômica: a modificação do lipopolissacarídeo (LPS), que altera a carga da membrana externa bacteriana e impede a ligação das polimixinas.
- LIU, Y. Y. et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study. The Lancet Infectious Diseases, v. 16, n. 2, p. 161-168, 2016. DOI: https://doi.org/10.1016/S1473-3099(15)00424-7.
- Resumo: Estudo histórico que descreveu pela primeira vez o gene mcr-1, um mecanismo de resistência à colistina mediado por plasmídeo, marcando um ponto de virada na epidemiologia da resistência às polimixinas.
- SUN, J.; ZHANG, L.; CHENG, J.; ZHANG, R.; WANG, Y. The evolution of mcr genes: a growing concern for public health. Microbiology Spectrum, v. 11, n. 5, e01428-23, 2023. DOI: https://doi.org/10.1128/spectrum.01428-23.
- Resumo: Revisão sobre a evolução e disseminação global dos genes mcr, destacando a diversidade de variantes (mcr-1 a mcr-10) e seu impacto na saúde pública.
- SHEN, Z.; WANG, Y.; SHEN, Y.; SHEN, J.; WU, C. Redefining the resistance levels of MCR-positive Escherichia coli to polymyxins. EBioMedicine, v. 29, p. 120-127, 2018. DOI: https://doi.org/10.1016/j.ebiom.2018.02.012.
- Resumo: Estudo que investiga os níveis de resistência conferidos pelos genes mcr, mostrando que, embora confiram resistência, os níveis podem variar, o que tem implicações para a detecção laboratorial e a terapia.
IX. Autor:
Antonio Tadeu Fernandes:
https://www.linkedin.com/in/mba-gest%C3%A3o-ccih-a-tadeu-fernandes-11275529/
https://www.instagram.com/tadeuccih/
#PolimixinaB #Colistina #AntimicrobialStewardship #CCIH #Infectologia #UTI #FarmáciaClínica #ControleDeInfecção #ResistênciaBacteriana #MedicinaBaseadaEmEvidências
Instituto CCIH+ Parceria permanente entre você e os melhores professores na sua área de atuação
Conheça nossos cursos de especialização ou MBA:
MBA Gestão em Saúde e Controle de Infecção
MBA Gestão em Centro de Material e Esterilização
MBA EQS – Gestão da Segurança do Paciente e governança clínica