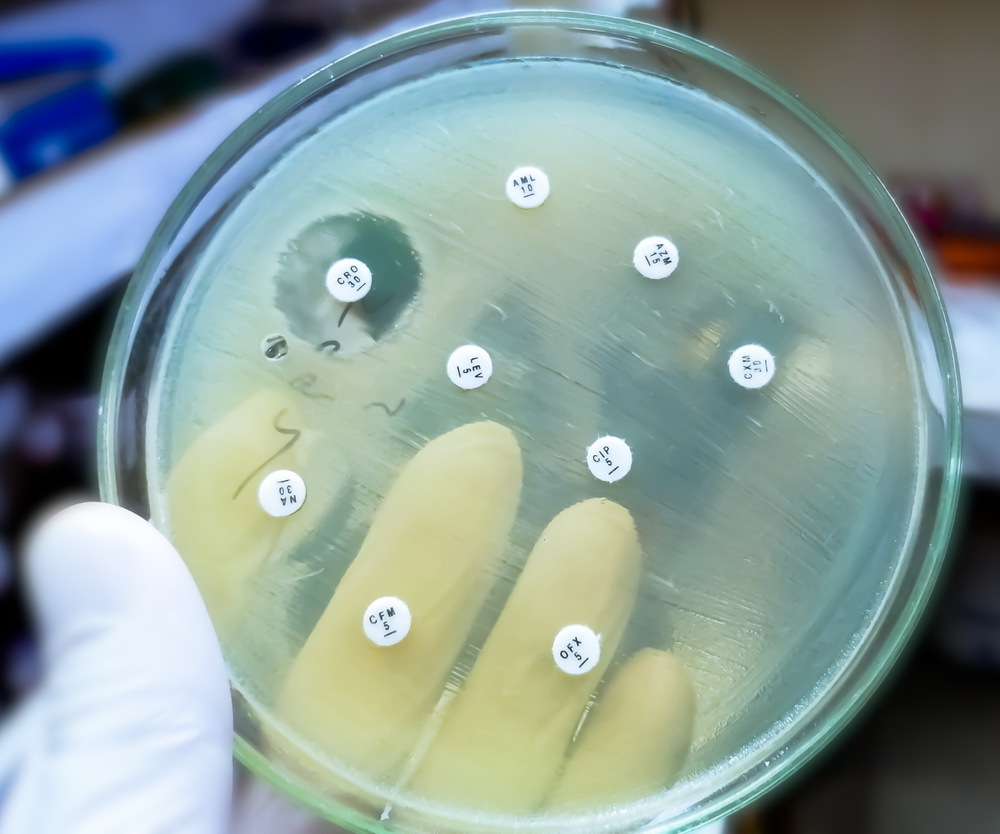
O que fazer quando a terapia antimicrobiana parece entrar em cheque? A multirresistência deixou de ser uma preocupação futura para se tornar uma realidade inquietante no presente. Cada decisão terapêutica, cada protocolo, cada escolha de antibiótico pode definir não apenas o desfecho de um paciente, mas também o futuro da eficácia dos antimicrobianos em nossas instituições.
Este artigo convida controladores de infecção e gestores hospitalares a refletirem: como podemos navegar com segurança em um mar onde as opções terapêuticas se estreitam perigosamente?
FAQ — Terapia antimicrobiana em xeque: estratégias de sobrevivência na era da multirresistência
1) O que significa “terapia antimicrobiana em xeque” hoje?
Resposta curta: A escalada da resistência colocou em risco a efetividade dos esquemas clássicos — exige decisão mais precisa, rápida e contextual.
Explicação: A “era dos antibióticos” impôs pressão seletiva sem precedentes; sobreviver agora implica integrar epidemiologia local, stewardship, diagnóstico rápido e princípios PK/PD. (CCIH Cursos)
2) Por que a multirresistência mudou o jogo?
Resposta curta: Mais patógenos com múltiplos mecanismos de resistência → menos opções, mais falhas terapêuticas, maior mortalidade e custos.
Explicação: O cenário força protocolos vivos, revisão de empirismo e vigilância contínua para evitar uso desnecessário de espectro amplo. (Serviços e Informações do Brasil)
3) Quais são os pilares práticos para “sobreviver” clinicamente?
Resposta curta: (a) escolha empírica guiada por risco/local; (b) diagnóstico rápido; (c) otimização PK/PD; (d) descalonamento precoce; (e) durações mais curtas quando possível; (f) prevenção/IPC forte. (Serviços e Informações do Brasil, CCIH Cursos)
4) Como escolher a terapia empírica na suspeita de Gram-negativos MDR?
Resposta curta: Baseie-se em gravidade, foco, colonização prévia, uso recente de antimicrobianos e epidemiologia local; reavalie ao sair o resultado.
Explicação: Diretrizes (ex.: IDSA/2024 para ESBL) reforçam risco-estratificação e ajuste rápido para evitar tanto sub-cobertura quanto excesso. (CCIH Cursos)
5) Combinação ou monoterapia?
Resposta curta: Sepse grave/altíssimo risco pode justificar combinação inicial; descalone para monoterapia dirigida assim que possível.
Explicação: O objetivo é encurtar o tempo até terapia efetiva sem prolongar espectro desnecessário.
6) Como aplicar PK/PD à beira-leito?
Resposta curta: Ajuste dose/intervalo/infusão ao alvo PK/PD do fármaco (tempo acima do MIC, AUC/MIC, Cmax/MIC) e ao clearance do paciente.
Explicação: Ex.: β-lactâmicos com infusão prolongada/contínua em pacientes graves; monitoramento terapêutico quando disponível.
7) E as durações ideais?
Resposta curta: O mínimo eficaz, guiado por foco/resposta clínica (p. ex., pneumonias, ITU, intra-abdominais).
Explicação: Reduzir dias desnecessários diminui resistência e eventos adversos; revisão diária com possibilidade de oral step-down.
8) Qual o papel do diagnóstico rápido e da genômica?
Resposta curta: Encurtam o tempo para terapia efetiva e o descalonamento.
Explicação: Painéis rápidos e, quando disponível, vigilância/genômica direcionam antibiótico e medidas de controle com precisão.
9) O que não pode faltar no stewardship?
Resposta curta: Protocolos claros, auditoria com feedback, restrição inteligente, revisão em 48–72h, métricas (DOT/DDD), e integração com microbiologia.
Explicação: A Diretriz ANVISA (2023) destaca o laboratório como parceiro estratégico da prescrição e dos protocolos. (Serviços e Informações do Brasil)
10) Como o controle de infecção (IPC) protege a terapia?
Resposta curta: Higiene das mãos, bundles por sítio, limpeza ambiental, precauções de contato/coorte conforme risco e vigilância ativa.
Explicação: Reduzir transmissão diminui a pressão de uso e preserva arsenal terapêutico.
11) Quais indicadores clínicos e gerenciais priorizar?
Resposta curta: Tempo até antibiótico efetivo, taxa de descalonamento, DOT/DDD por classe, duração média de tratamento, reinternações, e adesão a bundles/IPC.
Explicação: Painéis semanais iluminam excesso de espectro e oportunidades de encurtar durações.
12) O que um serviço pode fazer em 30–60–90 dias?
Resposta curta:
- 0–30: alinhar protocolo empírico por foco/risco; acordar alvos PK/PD; ativar revisão em 48–72h.
- 31–60: treinar equipe + painel (DOT/DDD, descalonamento, tempo até terapia efetiva).
- 61–90: incorporar diagnóstico rápido/fluxos e fechar governança com CCIH + microbiologia + farmácia.
13) Onde está o artigo completo?
Resposta curta: No site do Instituto CCIH+ a apresntado a seguir nesta página: “Terapia antimicrobiana em xeque: estratégias de sobrevivência na era da multirresistência”. (CCIH Cursos)
Introdução
A descoberta e o desenvolvimento de antibióticos representam, inquestionavelmente, um dos maiores triunfos da medicina do século XX. Esta revolução terapêutica transformou infecções outrora fatais em condições tratáveis, aumentando drasticamente a expectativa de vida e viabilizando avanços médicos complexos, como cirurgias de grande porte, transplantes de órgãos e quimioterapia (Ref 1, 2). Contudo, este período, frequentemente romantizado como a “era dos milagres”, carrega um paradoxo inerente: o próprio sucesso e a utilização em massa desses agentes terapêuticos aceleraram um processo evolutivo natural, culminando na crise global da resistência antimicrobiana (RAM) que hoje enfrentamos (Ref 3, 4). A era do otimismo deu lugar a uma realidade sombria, na qual a eficácia do nosso arsenal terapêutico diminui a um ritmo alarmante.
Este artigo, destinado a profissionais de saúde engajados no controle de infecção hospitalar e stewardship de antimicrobianos, propõe uma análise aprofundada e crítica do cenário atual da terapia com antibióticos. Partindo de uma perspectiva histórica, dissecaremos a trajetória da descoberta à estagnação, explorando as classes de antimicrobianos, seus mecanismos de ação e as limitações intrínsecas que sempre os acompanharam. Mergulharemos na complexa epidemiologia e nos mecanismos moleculares da resistência, com um foco particular no contexto brasileiro, para então avaliar criticamente os desafios clínicos e as estratégias de mitigação, como os programas de stewardship de antimicrobianos e de diagnóstico. Finalmente, projetaremos um olhar para o futuro, investigando as fronteiras da inovação — desde a redescoberta de produtos naturais e probióticos até o potencial disruptivo da inteligência artificial e da terapia com bacteriófagos, sem negligenciar a necessidade urgente de novos modelos econômicos para revitalizar a pesquisa e o desenvolvimento de novos antibióticos. Adentramos uma era “pós-milagre”, que exige não apenas conhecimento, mas uma mudança de paradigma: da simples prescrição à gestão estratégica de um recurso precioso e finito. A vigilância, a inovação e o stewardship não são mais opções, mas imperativos para a sustentabilidade da medicina moderna.
A Trajetória da Descoberta à Crise: Uma Perspectiva Histórica Crítica
A narrativa dos antibióticos é uma saga de engenhosidade científica, sucesso terapêutico e, por fim, de consequências não intencionais que definem os desafios da saúde global contemporânea. Compreender essa trajetória é fundamental para contextualizar a crise atual e para delinear estratégias futuras eficazes.
Da Alvorada à “Era de Ouro”: A Ascensão da Terapia Antimicrobiana
Antes da era dos antibióticos, as infecções bacterianas eram uma das principais causas de mortalidade, e procedimentos médicos hoje rotineiros eram repletos de perigos. A virada começou no início do século XX, com a síntese do Salvarsan por Paul Ehrlich em 1910, o primeiro agente quimioterápico sistêmico eficaz (Ref 5). No entanto, o marco definidor foi a descoberta acidental da penicilina por Alexander Fleming em 1928, a partir do fungo Penicillium notatum. A purificação e produção em larga escala, impulsionadas pela necessidade durante a Segunda Guerra Mundial, inauguraram a “Era de Ouro” dos antibióticos, um período de descobertas prolíficas entre 1940 e 1960 (Ref 5, 6).
Nessas duas décadas, a maioria das classes de antibióticos que utilizamos até hoje foi descoberta, incluindo os aminoglicosídeos (estreptomicina, 1943), as tetraciclinas (1948) e os macrolídeos (1952) (Ref 5). Essa explosão de inovação não apenas salvou milhões de vidas, mas também se tornou um pilar fundamental para o avanço da medicina. Procedimentos como cirurgias cardíacas, transplantes e tratamentos para o câncer, que induzem imunossupressão, tornaram-se viáveis porque o risco de infecções bacterianas pós-procedimento podia ser controlado (Ref 2). A medicina moderna, em sua essência, foi construída sobre a premissa de que tínhamos um arsenal eficaz contra as bactérias.
O Fim da “Era de Ouro” e o Vazio de Inovação
Tão abruptamente quanto começou, a “Era de Ouro” terminou. Após a década de 1960, a taxa de descoberta de novas classes de antibióticos despencou, dando origem ao que é hoje conhecido como o “vazio de inovação” ou “abismo de descoberta” (Ref 7). Este fenômeno não reflete uma exaustão de alvos biológicos, mas sim uma profunda falha de mercado. A análise econômica revela que o modelo tradicional de desenvolvimento farmacêutico, baseado em patentes e volume de vendas, é fundamentalmente inadequado para os antibióticos (Ref 8, 9).
O desenvolvimento de um novo medicamento é um processo longo e dispendioso, com um custo médio estimado em 1,3 bilhão de dólares para um novo anti-infeccioso sistêmico (Ref 8). No entanto, ao contrário de medicamentos para doenças crônicas, os antibióticos são usados por curtos períodos. Adicionalmente, o “paradoxo do stewardship” agrava o problema: os novos e mais potentes antibióticos, essenciais para combater infecções multirresistentes, são deliberadamente reservados como agentes de última linha para retardar o desenvolvimento de resistência. Esta prática, embora clinicamente prudente, suprime drasticamente o volume de vendas. Estima-se que um novo antibiótico precise gerar pelo menos 300 milhões de dólares em receita anual para ser sustentável, mas a maioria dos novos lançamentos alcança apenas entre 15 e 50 milhões de dólares por ano (Ref 8).
Essa desconexão entre o imenso valor social de um novo antibiótico e seu baixo retorno comercial levou a uma retirada em massa das grandes empresas farmacêuticas da pesquisa e desenvolvimento (P&D) de antibióticos. Elas redirecionaram seus investimentos para áreas mais lucrativas, como oncologia e doenças crônicas, deixando o pipeline de antibióticos perigosamente vazio (Ref 10). O vazio de inovação, portanto, não é primariamente uma falha científica, mas uma consequência direta de um modelo econômico que não recompensa a criação de bens de saúde pública essenciais. Este entendimento desloca o foco da solução do laboratório para a arena da política de saúde e da economia, tornando imperativa a discussão sobre novos modelos de financiamento.
O Paradoxo do Sucesso: Semeando as Sementes da Resistência
A resistência antimicrobiana é um fenômeno evolutivo natural. Em qualquer população bacteriana exposta a um agente seletivo, as variantes que possuem mecanismos de sobrevivência irão proliferar (Ref 4, 10). O que a era dos antibióticos fez foi aplicar uma pressão seletiva sem precedentes em escala global, acelerando drasticamente esse processo. O uso indiscriminado e, muitas vezes, inadequado de antibióticos na medicina humana é um dos principais motores dessa aceleração (Ref 5).
No entanto, o problema transcende a prática clínica. Estima-se que cerca de 70% do consumo global de antibióticos ocorra na agricultura e na pecuária, onde são utilizados não apenas para tratar infecções, mas também profilaticamente e como promotores de crescimento (Ref 11). Esse uso massivo cria vastos reservatórios de genes de resistência em animais e no ambiente, que podem ser transferidos para patógenos humanos.
Essa interconexão levou à consolidação do conceito de “Saúde Única” (One Health), que reconhece que a saúde humana, a saúde animal e a saúde ambiental estão intrinsecamente ligadas (Ref 12). A presença de genes de resistência de alto impacto, como os que codificam carbapenemases, em efluentes hospitalares e no ambiente aquático demonstra que a resistência não respeita fronteiras institucionais ou ecológicas (Ref 13). Portanto, qualquer estratégia eficaz de combate à RAM deve ser holística, abordando simultaneamente o uso de antibióticos em todas as frentes.
O Arsenal Terapêutico: Mecanismos de Ação e Espectros de Atividade
O arsenal de antimicrobianos desenvolvido ao longo do último século é diversificado, explorando diferentes vulnerabilidades na fisiologia bacteriana. No entanto, uma análise mais atenta revela que a grande maioria dos agentes clinicamente úteis converge para um número notavelmente pequeno de alvos celulares, uma vulnerabilidade estratégica que facilitou a evolução da resistência cruzada. A seguir, uma sinopse didática das principais classes, seus mecanismos e espectros de ação.
Inibidores da Síntese da Parede Celular (Beta-Lactâmicos e Glicopeptídeos)
A parede celular bacteriana, composta por uma malha de peptidoglicano, é uma estrutura essencial para a integridade osmótica da célula e um alvo ideal, pois não possui análogo em células eucarióticas.
Os beta-lactâmicos são a classe mais ampla e utilizada de antibióticos. Seu mecanismo de ação envolve a inibição das proteínas de ligação à penicilina (PBPs), enzimas transpeptidases que catalisam as ligações cruzadas finais na síntese do peptidoglicano. A inibição leva ao enfraquecimento da parede celular e à lise bacteriana (Ref 5). Esta classe evoluiu ao longo do tempo, gerando diversas subclasses:
- Penicilinas: Desde as naturais (Penicilina G) até as de espectro estendido (ampicilina, amoxicilina, piperacilina).
- Cefalosporinas: Classificadas em gerações (1ª a 5ª), com um espectro de atividade que se expande progressivamente contra bacilos Gram-negativos.
- Carbapenêmicos: (imipeném, meropeném) Possuem o espectro mais amplo, sendo frequentemente reservados para infecções por bactérias multirresistentes.
- Monobactâmicos: (aztreonam) Ativos principalmente contra bacilos Gram-negativos aeróbios.
A principal limitação desta classe é a resistência mediada por enzimas beta-lactamases, que hidrolisam o anel beta-lactâmico. Isso levou ao desenvolvimento de inibidores de beta-lactamases (ácido clavulânico, sulbactam, tazobactam), que são coadministrados para proteger o antibiótico da degradação (Ref 5).
Os glicopeptídeos (vancomicina, teicoplanina) também inibem a síntese da parede celular, mas por um mecanismo distinto: eles se ligam diretamente ao terminal D-alanil-D-alanina dos precursores do peptidoglicano, bloqueando estericamente a ação das transpeptidases e transglicosilases. Seu espectro é restrito a bactérias Gram-positivas, sendo cruciais no tratamento de infecções por Staphylococcus aureus resistente à meticilina (MRSA) e Enterococcus (Ref 5).
Inibidores da Síntese Proteica
O ribossomo bacteriano (70S, composto pelas subunidades 30S e 50S) é outro alvo seletivo, pois difere do ribossomo eucariótico (80S). Diversas classes de antibióticos exploram este alvo:
- Aminoglicosídeos (gentamicina, amicacina): Ligam-se irreversivelmente à subunidade 30S, causando erros na leitura do mRNA e a produção de proteínas aberrantes, resultando em um efeito bactericida rápido. São ativos principalmente contra bacilos Gram-negativos aeróbios (Ref 5).
- Tetraciclinas (doxiciclina, minociclina): Ligam-se reversivelmente à subunidade 30S, impedindo a ligação do aminoacil-tRNA ao sítio A do ribossomo, bloqueando a elongação da cadeia peptídica. Possuem amplo espectro (Gram-positivos, Gram-negativos, atípicos) e ação bacteriostática (Ref 5).
- Macrolídeos (azitromicina, claritromicina): Ligam-se à subunidade 50S, inibindo a translocação do peptidil-tRNA. São eficazes contra cocos Gram-positivos e patógenos atípicos (Ref 5).
- Lincosamidas (clindamicina): Também se ligam à subunidade 50S, com um mecanismo semelhante ao dos macrolídeos. São particularmente úteis contra bactérias anaeróbias e cocos Gram-positivos (Ref 5).
- Oxazolidinonas (linezolida): Uma classe mais recente que se liga a um sítio único na subunidade 50S, prevenindo a formação do complexo de iniciação 70S. São importantes para o tratamento de infecções por Gram-positivos multirresistentes, incluindo MRSA e Enterococcus resistente à vancomicina (VRE) (Ref 5).
Outros Mecanismos Relevantes
- Polipeptídeos (polimixinas, como a colistina): Atuam como detergentes catiônicos, interagindo com os lipopolissacarídeos (LPS) da membrana externa de bactérias Gram-negativas, desorganizando a integridade da membrana e causando extravasamento do conteúdo celular. Sua alta nefrotoxicidade os relegou a um papel de última linha terapêutica (Ref 5, 14).
- Antifúngicos: Atuam em alvos específicos dos fungos, como a síntese de ergosterol na membrana celular (azóis) ou ligando-se diretamente ao ergosterol para formar poros (polienos, como a anfotericina B) (Ref 5).
- Antituberculosos: O tratamento da tuberculose requer uma combinação de fármacos com mecanismos distintos para combater o Mycobacterium tuberculosis e prevenir a resistência. Os fármacos de primeira linha incluem a isoniazida (inibe a síntese de ácido micólico), a rifampicina (inibe a RNA polimerase), a pirazinamida e o etambutol (Ref 5).
A Tabela 1 a seguir consolida essas informações, oferecendo uma sinopse clínica para consulta rápida, um recurso didático valioso para a prática diária.
Tabela 1: Principais Classes de Antibióticos: Uma Sinopse Clínica
| Classe | Subclasse/Exemplos | Mecanismo de Ação | Espectro Primário | Considerações Clínicas / Toxicidade Chave |
| Inibidores da Parede Celular | ||||
| Beta-Lactâmicos | Penicilinas, Cefalosporinas, Carbapenêmicos | Inibição das proteínas de ligação à penicilina (PBPs), bloqueando a síntese de peptidoglicano. | Varia de Gram-positivos (Penicilina G) a espectro muito amplo (Carbapenêmicos). | Reações de hipersensibilidade são comuns. Risco de nefrotoxicidade e neurotoxicidade com altas doses, especialmente em carbapenêmicos. |
| Glicopeptídeos | Vancomicina, Teicoplanina | Liga-se ao terminal D-Ala-D-Ala dos precursores do peptidoglicano, bloqueando a polimerização. | Gram-positivos, incluindo MRSA e Enterococcus. | Nefrotoxicidade e ototoxicidade (monitoramento de níveis séricos é crucial). Síndrome do homem vermelho (infusional). |
| Inibidores da Síntese Proteica | ||||
| Aminoglicosídeos | Gentamicina, Amicacina | Liga-se à subunidade 30S, causando erro de leitura do mRNA (bactericida). | Bacilos Gram-negativos aeróbios. Sinergia com beta-lactâmicos para endocardite. | Nefrotoxicidade e ototoxicidade (irreversível) são dose-dependentes e significativas. Requer monitoramento terapêutico. |
| Tetraciclinas | Doxiciclina, Minociclina | Liga-se à subunidade 30S, bloqueando a chegada do tRNA (bacteriostático). | Amplo espectro: Gram-positivos, Gram-negativos, atípicos (clamídia, micoplasma), rickettsias. | Fotossensibilidade, distúrbios gastrointestinais. Contraindicado em gestantes e crianças < 8 anos (afeta dentes e ossos). |
| Macrolídeos | Azitromicina, Claritromicina | Liga-se à subunidade 50S, inibindo a translocação do ribossomo. | Cocos Gram-positivos, patógenos atípicos. | Distúrbios gastrointestinais, prolongamento do intervalo QT (risco de arritmias), interações medicamentosas (inibidores do CYP3A4). |
| Lincosamidas | Clindamicina | Liga-se à subunidade 50S, mecanismo similar aos macrolídeos. | Cocos Gram-positivos, anaeróbios (incluindo Bacteroides fragilis). Excelente penetração em abscessos. | Risco elevado de colite pseudomembranosa por Clostridioides difficile. Rash cutâneo. |
| Oxazolidinonas | Linezolida, Tedizolida | Liga-se à subunidade 50S, prevenindo a formação do complexo de iniciação. | Gram-positivos multirresistentes (MRSA, VRE). | Mielossupressão (trombocitopenia) com uso prolongado (>2 semanas). Risco de síndrome serotoninérgica com inibidores da MAO. |
| Outros Mecanismos | ||||
| Polipeptídeos | Polimixina B, Colistina | Atua como detergente catiônico, desestabilizando a membrana externa de Gram-negativos. | Bacilos Gram-negativos multirresistentes, incluindo Pseudomonas e Acinetobacter resistentes a carbapenêmicos. | Alta nefrotoxicidade e neurotoxicidade. Uso restrito a infecções graves sem outras opções terapêuticas. |
| Fluoroquinolonas | Ciprofloxacina, Levofloxacina | Inibem as topoisomerases bacterianas (DNA girase e topoisomerase IV), bloqueando a replicação do DNA. | Amplo espectro, com excelente atividade contra Gram-negativos e patógenos atípicos. | Tendinopatia (risco de ruptura do tendão de Aquiles), efeitos no SNC, prolongamento do QT, risco de dissecção de aorta. |
A Ameaça Onipresente da Resistência Antimicrobiana (RAM)
A resistência antimicrobiana não é uma ameaça futura, mas uma crise em andamento que reverte décadas de progresso médico. A sua disseminação é um fenômeno complexo, impulsionado por mecanismos moleculares sofisticados e por uma epidemiologia que transcende as paredes do hospital, exigindo uma abordagem multifacetada e global.
Mecanismos Moleculares de Resistência: Uma Análise Aprofundada
As bactérias desenvolveram um arsenal diversificado de estratégias para neutralizar os antibióticos. Os quatro mecanismos principais são (Ref 5):
- Inativação Enzimática: É a estratégia mais comum contra os beta-lactâmicos. As bactérias produzem enzimas, as beta-lactamases, que hidrolisam o anel beta-lactâmico, inativando o antibiótico. A evolução dessas enzimas é um exemplo clássico de corrida armamentista: das penicilinases simples às beta-lactamases de espectro estendido (ESBL) e, mais criticamente, às carbapenemases, que degradam quase todos os beta-lactâmicos. Um exemplo paradigmático é a New Delhi metalo-beta-lactamase 1 (NDM-1). Sendo uma metaloenzima (classe B), ela utiliza íons de zinco em seu sítio ativo para hidrolisar carbapenêmicos e não é inibida pelos inibidores de beta-lactamases de serina convencionais. O gene que a codifica, blaNDM-1, está localizado em elementos genéticos móveis (plasmídeos), o que permitiu sua rápida disseminação global entre diferentes espécies de Enterobacterales, tornando-se um dos maiores desafios no tratamento de infecções hospitalares (Ref 15, 16, 17).
- Modificação do Alvo: Mutações no sítio de ligação do antibiótico podem reduzir sua afinidade, tornando-o ineficaz. Exemplos clássicos incluem alterações nas PBPs que conferem resistência à meticilina em S. aureus (MRSA) e modificações na DNA girase que levam à resistência a fluoroquinolonas.
- Redução da Permeabilidade: Bactérias Gram-negativas possuem uma membrana externa que atua como uma barreira seletiva. A perda ou modificação de canais de porina, por onde muitos antibióticos hidrofílicos entram, pode diminuir a concentração intracelular do fármaco a níveis subletais, conferindo resistência, especialmente a carbapenêmicos em Pseudomonas aeruginosa.
- Efluxo Ativo: As bactérias possuem bombas de efluxo que reconhecem e expelem ativamente os antibióticos para fora da célula, impedindo que atinjam seu alvo em concentrações eficazes. Essas bombas podem ser específicas ou de amplo espectro, contribuindo para a multirresistência.
O Cenário Epidemiológico Global e Brasileiro
A RAM é uma pandemia silenciosa. Em 2019, estima-se que 1,27 milhão de mortes foram diretamente atribuíveis à RAM, com um total de 4,95 milhões de mortes associadas (Ref 18). A Organização Mundial da Saúde (OMS) publicou uma lista de patógenos prioritários para guiar a P&D de novos antibióticos, classificando como “críticos” os bacilos Gram-negativos resistentes a carbapenêmicos, como Acinetobacter baumannii, Pseudomonas aeruginosa e Enterobacterales (produtores de KPC e NDM) (Ref 19).
No Brasil, a situação é igualmente preocupante. O Plano de Ação Nacional de Prevenção e Controle da Resistência aos Antimicrobianos (PAN-BR) adota a abordagem de Saúde Única, integrando a vigilância na saúde humana, animal e ambiental (Ref 12, 20). Essa abordagem é validada por estudos que demonstram a disseminação ambiental de genes de resistência. Uma pesquisa em Campo Grande, Mato Grosso do Sul, por exemplo, detectou pela primeira vez a presença do gene blaKPC-2 em Enterobacterales resistentes a carbapenêmicos isolados de esgoto hospitalar (Ref 13). Este achado é crucial, pois evidencia que os hospitais atuam como epicentros que não apenas concentram, mas também disseminam determinantes de resistência para o ambiente. O esgoto hospitalar, carregado de antibióticos e bactérias resistentes, torna-se um “caldo de cultura” para a evolução e transferência horizontal de genes, contaminando os sistemas de água e contribuindo para um ciclo vicioso de resistência. Isso reforça a necessidade de políticas de tratamento de efluentes e de uma vigilância ambiental robusta, como preconizado pelo PAN-BR.
Síntese da Literatura Recente (2022-2024)
Uma revisão da literatura científica recente revela um campo dinâmico, com avanços significativos em algumas áreas e desafios persistentes em outras. A Tabela 2 sintetiza os principais achados.
Tabela 2: Síntese da Revisão de Literatura sobre Estratégias contra a RAM (2022-2024)
| Estratégia Terapêutica | Principais Achados / Status Atual | Maior Promessa | Principais Desafios / Lacunas |
| Pipeline de Novos Antibióticos | O pipeline clínico global é insuficiente, especialmente contra patógenos Gram-negativos críticos. Houve um aumento no foco em Gram-negativos, mas com poucos agentes verdadeiramente inovadores (novas classes/mecanismos). A maioria são derivados de classes existentes. (Ref 19, 21) | Aumento de agentes de amplo espectro contra Gram-negativos e um pipeline robusto para tuberculose. | Falta de inovação real; escassez de formulações orais e dados pediátricos; lacuna crítica em inibidores de metalo-beta-lactamases. |
| Descoberta Guiada por IA | A Inteligência Artificial (IA) e o Aprendizado de Máquina (ML) estão acelerando drasticamente a descoberta, permitindo a triagem de bilhões de moléculas em dias e a identificação de candidatos com novos mecanismos (ex: Halicina). (Ref 22, 23, 24) | Reduzir o tempo e o custo da fase de descoberta, identificar estruturas químicas não convencionais e projetar peptídeos antimicrobianos de novo. | Necessidade de dados de treinamento de alta qualidade (incluindo dados negativos); validação experimental ainda é um gargalo; transição do in silico para o clínico. |
| Terapia Fágica | Casos de uso compassivo e ensaios clínicos iniciais mostram alta eficácia contra infecções por MDR, especialmente em biofilmes e infecções de feridas. (Ref 25, 26, 27) | Alta especificidade (preserva o microbioma), capacidade de auto-replicação no local da infecção e eficácia contra biofilmes. | Padronização da produção (GMP), desafios regulatórios (FDA/EMA), desenvolvimento de resistência bacteriana aos fagos e resposta imune do hospedeiro. |
| Produtos Naturais | Renascimento do interesse, com foco em triagem de fontes inexploradas (ex: microbioma marinho), biologia sintética para criar análogos e uso como adjuvantes para restaurar a eficácia de antibióticos antigos. (Ref 28, 29, 30) | Vasta diversidade química, co-evolução com alvos bacterianos, potencial para novos mecanismos de ação e sinergia com antibióticos existentes. | Redescoberta frequente de compostos conhecidos; desafios na purificação, síntese em larga escala e otimização para propriedades farmacêuticas. |
Limitações Intrínsecas e Desafios Clínicos
Mesmo os antibióticos mais eficazes não são isentos de limitações. A toxicidade inerente e a necessidade de uma gestão clínica rigorosa são desafios constantes que acompanham o benefício terapêutico, exigindo uma abordagem de stewardship que vai além da simples escolha do fármaco.
Toxicidade e Efeitos Adversos: A Espada de Dois Gumes
A seletividade dos antibióticos nunca é absoluta. Quase todas as classes apresentam um perfil de toxicidade que os clínicos devem manejar cuidadosamente. Os aminoglicosídeos, por exemplo, são notórios por sua nefrotoxicidade e ototoxicidade, que pode ser irreversível, exigindo monitoramento rigoroso dos níveis séricos e da função renal (Ref 5). O cloranfenicol, embora de amplo espectro, carrega o risco raro, mas fatal, de depressão da medula óssea (anemia aplástica) (Ref 5).
Mesmo agentes mais modernos não estão isentos de riscos. As fluoroquinolonas estão associadas a efeitos adversos graves, incluindo tendinopatias com risco de ruptura, efeitos no sistema nervoso central e, mais recentemente, um risco aumentado de dissecção e aneurisma da aorta. As polimixinas, como a colistina, que ressurgiram como uma terapia de última linha para infecções por Gram-negativos multirresistentes, são altamente nefrotóxicas e neurotóxicas, representando um difícil cálculo de risco-benefício em pacientes críticos (Ref 14). Esta realidade sublinha que a eficácia antimicrobiana deve ser sempre ponderada contra o potencial de dano ao paciente.
O Papel Crucial do Stewardship na Prática Moderna
Diante da dupla ameaça da resistência e da toxicidade, a otimização do uso de antimicrobianos tornou-se uma disciplina central no controle de infecção hospitalar. Os Programas de Stewardship de Antimicrobianos (ASPs) são intervenções coordenadas e multifacetadas projetadas para promover o uso apropriado de antibióticos, com o objetivo de melhorar os desfechos dos pacientes, minimizar os efeitos adversos e reduzir a pressão seletiva que impulsiona a resistência (Ref 31, 32).
A evidência da eficácia dos ASPs é robusta. Múltiplas revisões sistemáticas e meta-análises demonstraram que a implementação de ASPs está associada a reduções significativas no consumo de antibióticos, nos custos hospitalares e nas taxas de infecção por patógenos resistentes (como MRSA e C. difficile), sem impactar negativamente a mortalidade ou o tempo de internação (Ref 33, 34, 35, 36).
No entanto, uma compreensão mais profunda revela que o stewardship de antimicrobianos é apenas uma parte da equação. Uma causa fundamental para o uso excessivo e inadequado de antibióticos, especialmente os de amplo espectro, é a incerteza diagnóstica. Na ausência de um diagnóstico rápido e preciso, os clínicos recorrem a terapias empíricas para cobrir os patógenos mais prováveis, uma prática necessária, mas que contribui para a pressão seletiva.
É aqui que surge o conceito de Stewardship de Diagnóstico como um parceiro sinérgico e indispensável. Este programa visa otimizar o uso de testes diagnósticos para garantir que o teste certo seja solicitado para o paciente certo, no momento certo, e que seus resultados sejam interpretados corretamente para guiar a terapia (Ref 37, 38, 39). A relação entre os dois stewardships é simbiótica: um diagnóstico melhor e mais rápido permite um stewardship de antimicrobianos mais eficaz.
A Agência para Pesquisa e Qualidade em Saúde (AHRQ) dos EUA propôs os “Quatro Momentos da Decisão sobre Antibióticos”, um framework que ilustra perfeitamente essa sinergia (Ref 38, 39):
- Momento 1: O paciente precisa de um antibiótico? O stewardship de diagnóstico intervém aqui, por exemplo, desencorajando a solicitação de uroculturas em pacientes assintomáticos ou o teste de C. difficile em pacientes usando laxantes, evitando assim tratamentos desnecessários baseados em colonização ou resultados falso-positivos.
- Momento 2: Culturas adequadas foram coletadas? Qual terapia empírica iniciar? O stewardship de diagnóstico melhora a qualidade da amostra (ex: técnica correta de coleta de urina) e orienta o uso de testes moleculares rápidos que podem identificar patógenos e genes de resistência em horas, permitindo uma terapia empírica mais direcionada.
- Momento 3: Posso parar ou descalonar o antibiótico? Os resultados do teste de sensibilidade são cruciais. O stewardship de diagnóstico pode implementar relatórios em cascata (liberando resultados de antibióticos de espectro mais estreito primeiro) para guiar o descalonamento.
- Momento 4: Qual a duração ideal da terapia? Um diagnóstico preciso é fundamental para definir a duração correta do tratamento, evitando cursos desnecessariamente longos.
Dessa forma, a ferramenta mais poderosa para preservar a eficácia do nosso arsenal atual pode não ser um novo fármaco, mas um novo teste diagnóstico. Um investimento robusto em stewardship de diagnóstico não é uma atividade complementar, mas uma estratégia central de combate à RAM, atuando como um multiplicador de força para os ASPs e, efetivamente, prolongando a vida útil dos antibióticos que já possuímos.
Horizontes Futuros e Estratégias Inovadoras
A crise da RAM exige uma reinvenção radical das nossas estratégias terapêuticas. A solução não reside apenas em encontrar o próximo “medicamento milagroso”, mas em construir um ecossistema de inovação diversificado que combine a sabedoria de abordagens antigas com o poder de tecnologias disruptivas e modelos de sustentabilidade econômica.
Reimaginando Soluções Antigas: Probióticos e Produtos Naturais
O crescente entendimento do microbioma humano reacendeu o interesse em estratégias que visam modular esta complexa comunidade ecológica. Os probióticos, definidos como microrganismos vivos que conferem um benefício à saúde do hospedeiro, emergem como uma alternativa promissora. Eles podem atuar através de múltiplos mecanismos: exclusão competitiva de patógenos, fortalecimento da barreira intestinal, modulação da resposta imune e produção de substâncias antimicrobianas. Estudos sugerem que os probióticos podem ajudar a prevenir a expansão do “resistoma” (o conjunto de todos os genes de resistência em uma população microbiana) e a mitigar os efeitos adversos dos antibióticos, como a diarreia associada a C. difficile (Ref 5).
Paralelamente, os produtos naturais estão vivendo um renascimento. Historicamente, a natureza, especialmente os microrganismos do solo, foi a principal fonte de antibióticos (Ref 5). Hoje, a abordagem vai além da triagem tradicional. A biologia sintética e a engenharia genômica permitem a ativação de “clusters de genes biossintéticos silenciosos” em microrganismos, revelando moléculas com potencial antimicrobiano que não são produzidas em condições de laboratório padrão. Além disso, produtos naturais estão sendo explorados não apenas como agentes diretos, mas como adjuvantes, moléculas que, embora sem atividade antimicrobiana própria, podem inibir mecanismos de resistência bacteriana (como bombas de efluxo) e restaurar a suscetibilidade a antibióticos mais antigos (Ref 2, 28, 30). A imensa biodiversidade, como a encontrada no Brasil, representa um reservatório químico vasto e ainda pouco explorado para essa nova fronteira da descoberta.
A Nova Onda de Terapias: Além dos Antibióticos Convencionais
Duas áreas de inovação destacam-se pelo seu potencial de transformar o tratamento de infecções multirresistentes:
- Terapia Fágica: O uso de bacteriófagos (vírus que infectam e matam bactérias específicas) é uma ideia antiga que está sendo revitalizada pela tecnologia moderna. Os fagos líticos oferecem vantagens notáveis: são altamente específicos para seu alvo bacteriano, poupando o microbioma comensal; replicam-se no local da infecção, aumentando a “dose” terapêutica; e são particularmente eficazes contra biofilmes, estruturas notoriamente resistentes aos antibióticos convencionais. Casos de uso compassivo e ensaios clínicos iniciais têm demonstrado sucesso notável no tratamento de infecções refratárias (Ref 25, 40, 41). No entanto, barreiras significativas permanecem, incluindo a necessidade de padronizar a produção em conformidade com as Boas Práticas de Fabricação (BPF), o desenvolvimento de vias regulatórias claras junto a agências como a FDA e a EMA, e a gestão da resposta imune do hospedeiro e da coevolução da resistência bacteriana aos fagos (Ref 26, 42, 43).
- Inteligência Artificial (IA) e Aprendizado de Máquina (ML): A IA não está apenas acelerando a descoberta de antibióticos; está mudando fundamentalmente como ela é feita. Modelos de aprendizado profundo (deep learning) podem analisar vastas bibliotecas químicas e prever a atividade antibacteriana de uma molécula a partir de sua estrutura, uma tarefa que levaria anos por métodos tradicionais. A descoberta da Halicina pelo MIT é um exemplo marcante: um modelo de IA treinado em um conjunto de dados de moléculas conhecidas identificou um composto, originalmente explorado para diabetes, como um potente antibiótico de amplo espectro com um novo mecanismo de ação, tudo isso em questão de dias (Ref 22, 24). Além da triagem, a IA está sendo usada para projetar de novo peptídeos antimicrobianos com propriedades otimizadas e até mesmo para minerar os proteomas de organismos extintos em busca de moléculas antigas com potencial terapêutico (Ref 22, 23).
Corrigindo o Sistema: Novos Modelos Econômicos e Regulatórios
A inovação científica, por si só, não resolverá a crise se os novos produtos não puderem chegar ao mercado de forma sustentável. A falha de mercado descrita anteriormente exige novos modelos econômicos que separem o retorno do investimento do volume de vendas. São os chamados incentivos “pull” (de atração), que complementam os incentivos “push” (de impulso), como subsídios à pesquisa.
O modelo mais discutido é o modelo de assinatura, apelidado de “modelo Netflix”. Nesse sistema, governos ou sistemas de saúde pagam à empresa farmacêutica uma taxa de acesso anual fixa por um novo antibiótico, independentemente de quantas doses são usadas. Isso garante um retorno financeiro previsível para a empresa, incentivando o P&D, ao mesmo tempo que remove a pressão para promover vendas, alinhando o lucro com os princípios de stewardship (Ref 44, 45). O Reino Unido e a Suécia já estão pilotando esses modelos. Outras propostas incluem recompensas de entrada no mercado (market entry rewards) e o fortalecimento de parcerias público-privadas globais, como a CARB-X e a GARDP, que financiam e orientam o desenvolvimento de novos antimicrobianos desde as fases iniciais (Ref 46, 44).
Recomendações e Síntese do Problema
Para o contexto brasileiro, a luta contra a RAM deve ser uma prioridade estratégica, alinhada com as diretrizes do PAN-BR. Com base na análise apresentada, as seguintes recomendações são propostas:
- Fortalecer e Integrar o Stewardship: Promover ativamente a integração do Stewardship de Diagnóstico em todos os Programas de Stewardship de Antimicrobianos (ASPs) hospitalares. Isso deve incluir investimentos em tecnologias de diagnóstico rápido e na capacitação de equipes multidisciplinares para interpretar e agir com base nos resultados.
- Ampliar a Vigilância sob a Ótica da Saúde Única: Expandir a vigilância da RAM para além dos isolados clínicos. É crucial monitorar sistematicamente os reservatórios de resistência em animais e no ambiente, especialmente em efluentes de serviços de saúde, para entender as rotas de disseminação e intervir de forma mais eficaz.
- Reivindicar por Novos Modelos de Financiamento: O Brasil, como um ator importante na saúde global, deve participar ativamente das discussões e do desenvolvimento de modelos de incentivo “pull”. A reivindicação em nível de política nacional e a colaboração internacional são essenciais para garantir o acesso futuro a antibióticos inovadores.
- Fomentar a Pesquisa Nacional em Terapias Não-Tradicionais: Incentivar e financiar a pesquisa em terapias alternativas, como a terapia fágica, e a prospecção de produtos naturais a partir da biodiversidade única do Brasil. A criação de redes de pesquisa e a colaboração entre universidades e indústria podem acelerar a translação dessas inovações para a prática clínica.
Conclusão
A era dos antibióticos, um dos pilares da medicina moderna, atingiu um ponto de inflexão crítico. A complacência deu lugar à urgência, à medida que a sombra da resistência antimicrobiana se alonga sobre todos os aspectos do cuidado em saúde. Estamos, de fato, em uma era “pós-milagre”, que não será definida pela busca de uma única solução mágica, mas pela implementação inteligente e sinérgica de uma gama diversificada de estratégias.
A jornada à frente exige uma mudança de paradigma fundamental. O combate à RAM não é mais apenas uma questão de descobrir a próxima molécula, mas de construir um sistema resiliente. Este sistema deve ser fundamentado em uma tríade de pilares: inovação científica, que vai desde a redescoberta da natureza até a aplicação de inteligência artificial; sabedoria clínica, manifestada através da gestão rigorosa e integrada dos stewardships de antimicrobianos e de diagnóstico; e inteligência em políticas de saúde, que deve redesenhar os modelos econômicos para que o valor para a saúde pública seja recompensado.
Para a comunidade de controle de infecção hospitalar no Brasil, o papel é central e multifacetado. Somos os guardiões do arsenal terapêutico existente, os implementadores das melhores práticas clínicas e os defensores de políticas que possam garantir um futuro sustentável. A tarefa é monumental, mas a inação tem um custo incalculável. Ao abraçar essa abordagem integrada — científica, clínica e política — podemos navegar com sucesso os desafios da era pós-milagre e preservar a capacidade da medicina de curar para as gerações futuras.
A gestão da terapia antimicrobiana em um cenário de multirresistência exige mais do que conhecimento técnico: demanda visão estratégica, coragem para decisões impopulares e compromisso com a sustentabilidade dos recursos terapêuticos. O desafio é enorme, mas também é a oportunidade de transformar práticas, fortalecer políticas institucionais e garantir que a ciência continue a oferecer soluções.
No fim, a pergunta que fica é: estamos prontos para mudar antes que seja tarde demais?
Referências bibliográficas
(Ref 1) STAMOVA, S. et al. A review of strategies for combating antimicrobial resistance: innovations, funding, and new therapeutic approaches. Journal of IMAB – Annual Proceeding (Scientific Papers) Supplement, 2024. Disponível em: https://www.researchgate.net/publication/388498774_A_REVIEW_OF_STRATEGIES_FOR_COMBATING_ANTIMICROBIAL_RESISTANCE_INNOVATIONS_FUNDING_AND_NEW_THERAPEUTIC_APPROACHES. Acesso em: 20 out. 2024.
(Ref 2) HUTCHINGS, M. I.; TRUMAN, A. W.; WILKINSON, B. Antibiotics: past, present and future. Current Opinion in Microbiology, v. 51, p. 72-80, 2019. doi: https://doi.org/10.1016/j.mib.2019.10.008.
(Ref 3) VENTOLA, C. L. The antibiotic resistance crisis: part 1: causes and threats. P & T: a peer-reviewed journal for formulary management, v. 40, n. 4, p. 277–283, 2015. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4378521/.
(Ref 4) DAVIES, J.; DAVIES, D. Origins and evolution of antibiotic resistance. Microbiology and Molecular Biology Reviews, v. 74, n. 3, p. 417-433, 2010. doi: https://doi.org/10.1128/MMBR.00016-10.
(Ref 5) DHARA, A. K.; NAYAK, A. K. Introduction to antibiotic therapy. In: DHARA, A. K.; NAYAK, A. K.; CHATTOPADHYAY, D. (Eds.). Antibiotics – Therapeutic Spectrum and Limitations. Academic Press, 2023. p. 3-18. doi: https://doi.org/10.1016/B978-0-323-95388-7.00002-4.
(Ref 6) AMINOV, R. I. A brief history of the antibiotic era: lessons learned and challenges for the future. Frontiers in Microbiology, v. 1, p. 134, 2010. doi: https://doi.org/10.3389/fmicb.2010.00134.
(Ref 7) SILVER, L. L. A perfect storm in antibiotic discovery. Annals of the New York Academy of Sciences, v. 1277, n. 1, p. 1, 2013. doi: https://doi.org/10.1111/nyas.12096.
(Ref 8) PLACKETT, B. Why big pharma has abandoned antibiotics. Nature, v. 586, p. S50-S52, 2020. doi: https://doi.org/10.1038/d41586-020-02884-3.
(Ref 9) REBITZER, J. B.; REBITZER, R. S. Why not better and cheaper healthcare and innovation? Milken Institute Review, 2024. Disponível em: https://www.milkenreview.org/articles/book-excerpt-two-why-not-better-and-cheaper-healthcare-and-innovation?IssueID=53.
(Ref 10) GONZÁLEZ-BELLO, C. The antibiotic resistance crisis. ACS Infectious Diseases, v. 6, n. 11, p. 2781–2783, 2020. doi: https://doi.org/10.1021/acsinfecdis.0c00650.
(Ref 11) INVESTOR ACTION ON ANTIMICROBIAL RESISTANCE. Progress Report 2022. 2023. Disponível em: https://collaborate.unpri.org/system/files/2024-03/IAonAMR_Progress_Report_2022.pdf.
(Ref 12) BRASIL. Ministério da Saúde. Plano de Ação Nacional de Prevenção e Controle da Resistência aos Antimicrobianos no Âmbito da Saúde Única (PAN-BR). Brasília, 2018. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/plano_acao_nacional_prevencao_controle_resistencia_antimicrobianos.pdf.
(Ref 13) SOUZA, V. F. et al. Carbapenem-resistant Enterobacteriaceae in hospital and non-hospital effluents in midwest Brazil. Brazilian Journal of Biology, v. 84, e266800, 2024. doi: https://doi.org/10.1590/1519-6984.266800.
(Ref 14) ZASOWSKI, E. J. et al. The evolving landscape of polymyxin B and colistin use. Expert Review of Anti-infective Therapy, v. 22, n. 4, p. 251-266, 2024. doi: https://doi.org/10.1080/14787210.2024.2335193.
(Ref 15) BIAU, J. et al. Carbapenem-resistant Enterobacterales (CRE): a review of the situation in 2024. Microorganisms, v. 12, n. 5, p. 978, 2024. doi: https://doi.org/10.3390/microorganisms12050978.
(Ref 16) WALSH, T. R.; TYE, G. J. The NDM-1 carbapenemase: a new challenge for global public health. Clinical Infectious Diseases, v. 53, n. 3, p. 283-285, 2011. doi: https://doi.org/10.1093/cid/cir411.
(Ref 17) KUMARASAMY, K. K. et al. Emergence of a new antibiotic resistance mechanism in India, Pakistan, and the UK: a molecular, biological, and epidemiological study. The Lancet Infectious Diseases, v. 10, n. 9, p. 597-602, 2010. doi: https://doi.org/10.1016/S1473-3099(10)70143-2.
(Ref 18) ANTIMICROBIAL RESISTANCE COLLABORATORS. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. The Lancet, v. 399, n. 10325, p. 629-655, 2022. doi: https://doi.org/10.1016/S0140-6736(21)02724-0.
(Ref 19) WORLD HEALTH ORGANIZATION. 2023 antibacterial agents in clinical and preclinical development: an overview and analysis. Geneva: WHO, 2024. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC11876093/.
(Ref 20) BRASIL. Agência Nacional de Vigilância Sanitária. Plano Nacional para a Prevenção e o Controle da Resistência aos Antimicrobianos nos Serviços de Saúde (PAN-SERVIÇOS DE SAÚDE) 2023-2027. Brasília, 2023. Disponível em: https://www.ccih.med.br/wp-content/uploads/2023/12/pan-servicos-de-saude-2023-2027-final-15-12-2023.pdf.
(Ref 21) BOYD, N. K.; TENG, C.; FREI, C. R. Brief Overview of Approaches and Challenges in New Antibiotic Development: A Focus on Drug Repurposing. Frontiers in Cellular and Infection Microbiology, v. 11, 783141, 2021. doi: https://doi.org/10.3389/fcimb.2021.684515.
(Ref 22) DE LA FUENTE-NÚÑEZ, C. How artificial intelligence is accelerating antibiotic discovery. Physical Sciences Reviews, 2024. doi: https://doi.org/10.1515/psr-2023-0118.
(Ref 23) WONG, F. et al. Discovery of a structural class of antibiotics with explainable deep learning. Nature, v. 623, p. 1045-1052, 2023. doi: https://doi.org/10.1038/s41586-023-06887-8.
(Ref 24) TALAT, M. A.; KHAN, A. U. The application of artificial intelligence in antibiotic discovery: an overview of current and future perspective. International Journal of Advanced Research, v. 11, n. 4, p. 1326-1332, 2023. doi: https://doi.org/10.21474/IJAR01/16843.
(Ref 25) AL-NUSSIR, S. et al. Phage Therapy for Multidrug-Resistant Infections: A Comprehensive Review of Clinical Trials and Case Studies. medRxiv, 2025. doi: https://doi.org/10.1101/2025.04.19.25325436.
(Ref 26) ABEDON, S. T. et al. Phage therapy: challenges and opportunities. Annual Review of Virology, v. 11, p. 1-19, 2024. doi: https://doi.org/10.1146/annurev-virology-120222-044033.
(Ref 27) KORTWRIGHT, K. E. et al. Phage therapy: a renewed approach to combat antibiotic-resistant bacteria. Cell Host & Microbe, v. 25, n. 2, p. 219-232, 2019. doi: https://doi.org/10.1016/j.chom.2019.01.014.
(Ref 28) COX, G. et al. Natural product antibiotics: from traditional screening to novel discovery strategies. Nature Reviews Drug Discovery, v. 23, p. 451-470, 2024. doi: https://doi.org/10.1038/s41573-024-00899-y.
(Ref 29) WRIGHT, G. D. The complexity of natural product antibiotics. Journal of Clinical Investigation, v. 134, n. 15, e187996, 2024. doi: https://doi.org/10.1172/JCI187996.
(Ref 30) MIETHKE, M. et al. Towards the sustainable discovery and development of new antibiotics. Nature Reviews Chemistry, v. 5, p. 726–749, 2021. doi: https://doi.org/10.1038/s41570-021-00313-1.
(Ref 31) NATHWANI, D. et al. A review of the impact of antimicrobial stewardship programs in hospitals. Clinical Microbiology and Infection, v. 25, n. 11, p. 1350-1357, 2019. doi: https://doi.org/10.1016/j.cmi.2019.04.027.
(Ref 32) AL-OMAR, A. et al. Impact of an Antimicrobial Stewardship Program at a Tertiary Care Hospital. Journal of Drug Delivery and Therapeutics, v. 14, n. 5, p. 1-8, 2024. doi: https://doi.org/10.22270/jddt.v14i5.6553.
(Ref 33) BASTIAN, T. et al. Impact of an antimicrobial stewardship programme on antibiotic utilization and resistance burden in patients with acute leukaemia: an 11-year longitudinal cohort study. Journal of Antimicrobial Chemotherapy, v. 79, n. 10, dkae258, 2024. doi: https://doi.org/10.1093/jac/dkae258.
(Ref 34) BAGGIO, D. et al. The impact of a ward-based antimicrobial stewardship program on prescription quality, consumption, and costs. Infection and Drug Resistance, v. 17, p. 3433-3441, 2024. doi: https://doi.org/10.2147/IDR.S500379.
(Ref 35) BAUR, D. et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis. The Lancet Infectious Diseases, v. 17, n. 9, p. 990-1001, 2017. doi: https://doi.org/10.1016/S1473-3099(17)30325-0.
(Ref 36) ZHANG, Y. et al. Impact of a national antimicrobial stewardship program on antimicrobial consumption and bacterial resistance in a tertiary hospital in China. Infection and Drug Resistance, v. 17, p. 3963-3975, 2024. doi: https://doi.org/10.2147/IDR.S464019.
(Ref 37) MORGAN, D. J. et al. Improving antimicrobial use through better diagnosis: the relationship between diagnostic stewardship and antimicrobial stewardship. Infection Control & Hospital Epidemiology, v. 44, n. 12, p. 1901-1907, 2023. doi: https://doi.org/10.1017/ice.2023.167.
(Ref 38) JENKINS, T. C.; PATEL, R. Diagnostic stewardship: a core component of antimicrobial stewardship. Clinical Infectious Diseases, v. 76, n. 3, p. 556-562, 2023. doi: https://doi.org/10.1093/cid/ciac555.
(Ref 39) TAMMA, P. D. et al. A call to action: the role of diagnostic stewardship in combating antimicrobial resistance. Clinical Infectious Diseases, v. 76, n. 3, p. 549-555, 2023. doi: https://doi.org/10.1093/cid/ciac554.
(Ref 40) LEBEAUX, D. et al. A review of clinical trials of phage therapy for multidrug-resistant bacterial infections. The Lancet Infectious Diseases, v. 23, n. 10, p. e415-e425, 2023. doi: https://doi.org/10.1016/S1473-3099(23)00282-2.
(Ref 41) PIRNAY, J. P. et al. The phage therapy paradigm: from case-by-case applications to standardized products. Cell Host & Microbe, v. 32, n. 7, p. 1093-1105, 2024. doi: https://doi.org/10.1016/j.chom.2024.05.011.
(Ref 42) LUONG, T. et al. Navigating the regulatory landscape for phage therapy: past, present, and future. Pharmaceuticals, v. 13, n. 8, p. 175, 2020. doi: https://doi.org/10.3390/ph13080175.
(Ref 43) TURNER, D. et al. Overcoming regulatory and manufacturing challenges in phage therapy. Nature Reviews Drug Discovery, v. 22, p. 733-750, 2023. doi: https://doi.org/10.1038/s41573-023-00726-w.
(Ref 44) ÅRDAL, C. et al. New economic models for antibiotic development. Nature Reviews Drug Discovery, v. 19, p. 141-142, 2020. doi: https://doi.org/10.1038/d41573-020-00020-8.
(Ref 45) AUSTRALIAN ANTIMICROBIAL RESISTANCE NETWORK. 2023-2024 Pre-Budget Submission. 2023. Disponível em: https://www.mtpconnect.org.au/images/AAMRNet%20Pre-budget%20Submission%202023-24.pdf.
(Ref 46) REX, J. H. et al. A comprehensive review of pull incentives for antimicrobial R&D. Health Affairs, v. 42, n. 8, p. 1084-1092, 2023. doi: https://doi.org/10.1377/hlthaff.2023.00318.
Elaborado por:
Antonio Tadeu Fernandes:
https://www.linkedin.com/in/mba-gest%C3%A3o-ccih-a-tadeu-fernandes-11275529/
https://www.instagram.com/tadeuccih/
#AMR #ResistenciaAntimicrobiana #PoliticaDeSaude #ControleDeInfeccao #SaudePublica #Inovacao #Stewardship #OneHealth #LiderancaEmSaude #MDR
Instituto CCIH+ Parceria permanente entre você e os melhores professores na sua área de atuação
Conheça nossos cursos de especialização ou MBA:
MBA Gestão em Saúde e Controle de Infecção
MBA Gestão em Centro de Material e Esterilização
MBA EQS – Gestão da Segurança do Paciente e governança clínica
Especialização em Farmácia Clínica e Hospitalar
Pós-graduação em Farmácia Oncológica