O Imuno-Stewardship comprova que o controle de infecção não deve se limitar ao Stewardshipe de antibióticos, entendendo o papel das defesas naturais do paciente, especificamente o complemento.
As infecções relacionadas à assistência à saúde (IRAS) continuam sendo um dos maiores desafios da medicina moderna. Durante décadas, o foco da prevenção esteve em antimicrobianos e medidas ambientais, mas o crescimento dos patógenos multirresistentes e a complexidade da sepse exigem uma nova perspectiva. No centro dessa revolução está o Sistema Complemento, uma rede ancestral e poderosa de proteínas que atua como sentinela imunológica e linha de frente contra microrganismos invasores
Este artigo propõe uma reflexão estratégica: e se a verdadeira chave para o futuro do controle de infecções hospitalares não estiver apenas em novos antibióticos, mas na capacidade de modular e proteger a resposta imune inata dos pacientes? Essa visão inaugura o conceito de Imuno-Stewardship, que amplia o protagonismo das Comissões de Controle de Infecção Hospitalar (CCIH) e redefine a segurança do paciente.
FAQ: Imuno-Stewardship, Sistema Complemento e o Cuidado ao Paciente Crítico
Esta seção de perguntas frequentes foi criada para aprofundar o conhecimento de médicos, farmacêuticos e enfermeiros sobre o conceito emergente de Imuno-Stewardship, com foco no sistema complemento, e como essa nova perspectiva pode otimizar o manejo de infecções e a resposta do hospedeiro, indo além da antibioticoterapia tradicional.
I. Fundamentos sobre Imuno-Stewardship e Sistema Complemento
1. O que é Imuno-Stewardship?
Imuno-Stewardship é um conceito que propõe a gestão racional e otimizada da resposta imune do paciente. Assim como o Antimicrobial Stewardship gerencia o uso de antibióticos, o Imuno-Stewardship busca modular a resposta inflamatória do hospedeiro para combater a infecção de forma eficaz, minimizando o dano tecidual causado por uma resposta imune desregulada.
- Referência: Imuno-Stewardship e o Complemento: Quando o Controle de Infecção Vai Além do Antibiótico
2. O que é o Sistema Complemento e por que ele é importante?
O Sistema Complemento é um conjunto de mais de 50 proteínas presentes no sangue que atua como uma cascata enzimática crucial para a defesa contra patógenos e para a modulação da inflamação. Ele é um pilar do sistema imune inato, ajudando a destruir microrganismos, sinalizar outras células de defesa e limpar complexos imunes.
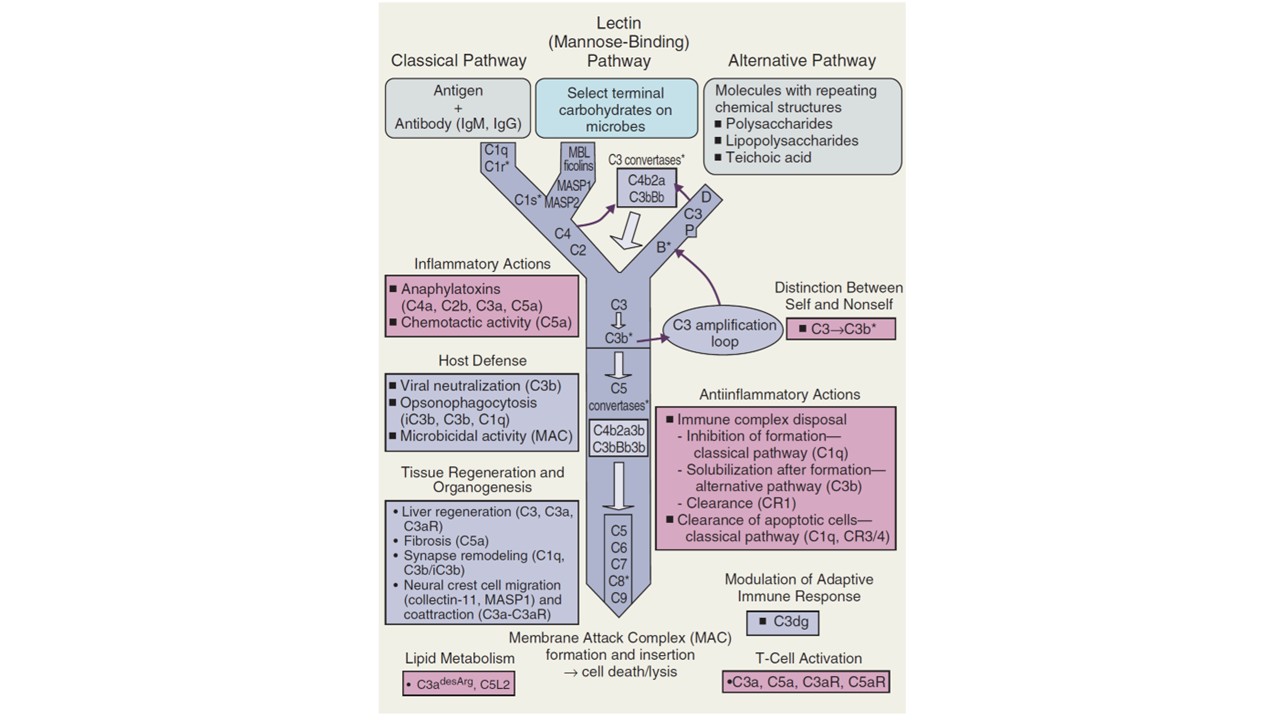
3. Quais são as três principais vias de ativação do Sistema Complemento?
As três vias são:
- Via Clássica: Geralmente ativada por complexos de anticorpo-antígeno.
- Via da Lectina: Ativada quando a lectina ligadora de manose (MBL) se liga a açúcares na superfície de patógenos.
- Via Alternativa: Ativada espontaneamente em baixo nível e amplificada na superfície de microrganismos que não possuem mecanismos de proteção.
- Referência: Imuno-Stewardship e o Complemento: Quando o Controle de Infecção Vai Além do Antibiótico
4. O que acontece quando o Sistema Complemento é ativado?
A ativação de qualquer uma das vias leva a uma cascata de eventos que culmina na formação do Complexo de Ataque à Membrana (MAC), que perfura a membrana do patógeno, levando à sua morte. Além disso, são gerados subprodutos (anafilatoxinas C3a e C5a) que recrutam células imunes e promovem a inflamação.
- Referência: The Role of Complement in Infectious Diseases
5. Como o Sistema Complemento pode causar danos ao próprio organismo?
Uma ativação excessiva ou descontrolada do Sistema Complemento, como ocorre na sepse, pode levar à destruição de células saudáveis, inflamação exacerbada, dano endotelial e formação de microtrombos. Essa “fúria” do complemento contribui significativamente para a lesão tecidual e a falência de múltiplos órgãos.
- Referência: Imuno-Stewardship e o Complemento: Quando o Controle de Infecção Vai Além do Antibiótico
II. Imuno-Stewardship e Sepse
6. Qual a relação entre o Sistema Complemento e a sepse?
Na sepse, os patógenos ativam massivamente o Sistema Complemento. As anafilatoxinas C3a e C5a são liberadas em grande quantidade, gerando uma “tempestade de citocinas” e uma inflamação sistêmica desregulada. Esse processo é um dos principais motores da disfunção orgânica que caracteriza a sepse.
7. O que é a “paralisia imune” na sepse e como o Imuno-Stewardship se aplica?
Após a fase hiperinflamatória, a sepse pode levar a um estado de imunossupressão ou “paralisia imune”, onde o corpo fica vulnerável a infecções secundárias. O Imuno-Stewardship busca identificar o estado imune do paciente (hiperinflamado vs. imunossuprimido) para, futuramente, guiar terapias que possam restaurar o equilíbrio, seja freando a inflamação ou estimulando a imunidade.
8. Por que apenas o uso de antibióticos pode não ser suficiente no tratamento da sepse?
Embora essenciais para eliminar o patógeno, os antibióticos não tratam a resposta inflamatória desregulada do hospedeiro, que é a causa da disfunção orgânica. A lise bacteriana causada pelos antibióticos pode, inclusive, liberar mais PAMPs (Padrões Moleculares Associados a Patógenos), intensificando temporariamente a ativação do complemento e a inflamação.
- Referência: Imuno-Stewardship e o Complemento: Quando o Controle de Infecção Vai Além do Antibiótico
9. Onde posso assistir a um vídeo para entender melhor a sepse?
O canal da CCIH no YouTube possui vídeos didáticos que explicam os conceitos fundamentais da sepse, sua gravidade e a importância do reconhecimento precoce.
- Referência: YouTube CCIH – O que é Sepse?
10. O conceito de Imuno-Stewardship muda a abordagem da reparação volêmica na sepse?
Ele reforça a importância da cautela. A reparação volêmica agressiva pode levar a um edema tecidual e sobrecarga de fluidos, piorando a inflamação e a disfunção orgânica. O Imuno-Stewardship incentiva uma abordagem mais personalizada, monitorando a resposta do paciente para evitar danos iatrogênicos.
- Referência: Conservative versus Liberal Fluid Strategy in Sepsis: An Updated Systematic Review and Meta-Analysis
III. Diagnóstico e Monitoramento
11. É possível medir a ativação do Sistema Complemento na prática clínica?
A dosagem de componentes como C3, C4, ou produtos de ativação como C3a e C5a, ainda não é rotineira para o manejo da sepse, sendo mais usada em reumatologia ou nefrologia. No entanto, a pesquisa de biomarcadores que reflitam a ativação do complemento é uma área promissora para estratificar o risco e guiar futuras terapias imunomoduladoras.
- Referência: Complement biomarkers in sepsis
12. Quais outros biomarcadores inflamatórios são úteis no contexto da sepse?
Biomarcadores como a Proteína C Reativa (PCR) e a Procalcitonina (PCT) são amplamente utilizados para indicar a presença de inflamação e infecção bacteriana. Embora não meçam diretamente a função do complemento, seus níveis refletem a resposta inflamatória global, na qual o complemento tem papel central.
13. O que é o endotélio e qual sua importância na sepse?
O endotélio é a camada de células que reveste os vasos sanguíneos. Na sepse, a ativação do complemento e a tempestade de citocinas causam dano endotelial (endoteliopatia), levando ao aumento da permeabilidade vascular (“vasamento” de fluidos), formação de trombos e disfunção da microcirculação.
14. Como a análise do perfil imunológico do paciente pode ajudar?
A fenotipagem imune (análise das populações de células de defesa e seus marcadores de ativação) é uma ferramenta de pesquisa que pode ajudar a determinar se o paciente está em um estado hiperinflamatório ou imunossuprimido. No futuro, isso pode permitir uma imunoterapia personalizada.
15. O conceito de Imuno-Stewardship se aplica a outras condições além da sepse?
Sim. A gestão da resposta imune é relevante em diversas condições, como grandes cirurgias, traumas, pancreatite aguda, e até mesmo em infecções virais graves como a COVID-19, onde a inflamação descontrolada é um fator chave da gravidade da doença.
IV. Implicações para o Médico
16. Existem medicamentos que inibem o Sistema Complemento?
Sim. Já existem inibidores do complemento aprovados para doenças raras (ex: Eculizumabe, um inibidor de C5). Vários outros estão em estudo para sepse, mas ainda sem indicação clínica formal. O desafio é saber em qual paciente e em que momento utilizá-los para obter benefício sem causar imunossupressão excessiva.
- Referência: Targeting the Complement System in Sepsis
17. Como o conceito de Imuno-Stewardship impacta a prescrição de antibióticos?
Ele reforça os princípios do Antimicrobial Stewardship: iniciar o antibiótico certo o mais rápido possível, mas também descalonar ou suspender quando apropriado. A ideia é eliminar o gatilho infeccioso sem prolongar desnecessariamente a exposição a antibióticos, o que pode alterar a microbiota e ter seus próprios efeitos inflamatórios.
- Referência: CCIH – Uso Racional de Antimicrobianos
18. A corticoterapia na sepse é uma forma de Imuno-Stewardship?
De certa forma, sim. O uso de baixas doses de corticosteroides no choque séptico refratário é uma das poucas estratégias imunomoduladoras com algum benefício demonstrado, pois visa conter a inflamação excessiva. No entanto, seu uso deve ser criterioso, pois pode aumentar o risco de infecções secundárias.
- Referência: Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock 2021
19. O que significa “controlar o foco da infecção”?
Além dos antibióticos, é fundamental remover a fonte da infecção sempre que possível. Isso inclui a drenagem de abscessos, a remoção de cateteres infectados ou o desbridamento de tecido necrótico. Sem o controle do foco, a ativação do complemento e a resposta inflamatória persistirão.
20. Onde encontro mais vídeos sobre o uso de antimicrobianos?
O canal da CCIH no YouTube oferece uma playlist dedicada ao tema, com discussões sobre classes de antibióticos, mecanismos de resistência e estratégias de otimização de uso.
- Referência: YouTube CCIH – Playlist Antimicrobianos
V. Implicações para o Farmacêutico
21. Qual o papel do farmacêutico clínico no Imuno-Stewardship?
O farmacêutico pode atuar na seleção de terapias com menor potencial inflamatório, monitorar e sugerir ajustes em drogas imunomoduladoras (como corticoides), e garantir o manejo farmacoterapêutico otimizado que minimize o estresse metabólico e inflamatório do paciente, além de seu papel central no Antimicrobial Stewardship.
22. Alguns antibióticos possuem efeitos imunomoduladores?
Sim. Certas classes de antibióticos, como os macrolídeos (ex: azitromicina), demonstraram ter efeitos anti-inflamatórios independentes de sua ação bactericida. Esse conhecimento pode ser relevante na escolha terapêutica em contextos específicos.
- Referência: Immunomodulatory properties of macrolides
23. Como a farmacocinética é alterada na sepse e como isso se relaciona com a resposta imune?
A inflamação sistêmica, o dano endotelial e a reposiçãoo volêmica na sepse alteram drasticamente a distribuição e eliminação dos fármacos. Doses inadequadas podem levar à falha terapêutica (subdose) ou toxicidade (sobredose), ambas contribuindo para a piora do quadro clínico e da resposta imune. O ajuste farmacocinético/farmacodinâmico (PK/PD) é essencial.
24. Qual a importância da reconciliação medicamentosa em pacientes críticos?
É fundamental para identificar e suspender medicamentos que possam estar contribuindo para a disfunção imune ou piora do quadro clínico. O farmacêutico tem um papel central nesse processo, garantindo a segurança e a adequação da farmacoterapia do paciente.
VI. Implicações para o Enfermeiro
25. Como a equipe de enfermagem pode aplicar os princípios do Imuno-Stewardship na prática?
A enfermagem aplica esses princípios através da prevenção de infecções (que são o principal gatilho da desregulação imune), do monitoramento rigoroso de sinais de deterioração clínica, da implementação de protocolos de sepse, e da garantia de um cuidado que minimize o estresse fisiológico do paciente (ex: manejo da dor, sedação e nutrição).
- Referência: CCIH – Prevenção de Infecção Hospitalar
26. Qual a importância do monitoramento de sinais vitais na detecção da resposta inflamatória?
A monitorização contínua de frequência cardíaca, respiratória, pressão arterial e temperatura é a forma mais básica e eficaz de detectar a Síndrome da Resposta Inflamatória Sistêmica (SIRS). A enfermagem está na linha de frente para identificar essas alterações precocemente e acionar a equipe.
27. De que forma os cuidados com dispositivos invasivos (cateteres, tubos) impactam a resposta imune do paciente?
Cada dispositivo invasivo é uma porta de entrada para patógenos e um estímulo inflamatório. A manutenção rigorosa da técnica asséptica durante a inserção e o manuseio, seguindo os bundles de prevenção, é uma intervenção de enfermagem de alto impacto que previne infecções e, consequentemente, a ativação desregulada do complemento.
28. O manejo da temperatura do paciente (febre/hipotermia) é uma forma de modular a resposta imune?
Sim. A febre é uma resposta fisiológica à infecção, mas a hipertermia extrema pode ser prejudicial. Da mesma forma, a hipotermia é um sinal de mau prognóstico. O controle térmico, seja através de antitérmicos ou medidas de aquecimento, é uma intervenção de enfermagem que ajuda a manter a homeostase do paciente.
29. Por que a mobilização precoce e a nutrição adequada são importantes no Imuno-Stewardship?
A imobilidade e a desnutrição são fatores que pioram a disfunção imune e aumentam a suscetibilidade a infecções. A atuação da equipe multiprofissional, com a enfermagem promovendo a mobilização e garantindo a administração da terapia nutricional, é fundamental para a recuperação imunológica do paciente.
30. Onde posso encontrar mais recursos sobre prevenção de infecção e cuidados ao paciente crítico?
O site e o canal do YouTube da CCIH são excelentes fontes de conhecimento, com artigos, notícias, vídeos e cursos que abordam as melhores práticas para a segurança do paciente e o controle de infecções hospitalares.
- Referências:
Para Além do Antibiograma: Redescobrindo o Terreno Biológico nas Infecções Hospitalares
No cenário contemporâneo do controle de infecções hospitalares (IRAS), a otimização do uso de antimicrobianos, ou Antimicrobial Stewardship, consolidou-se como um pilar indispensável. Contudo, a ascensão de patógenos multirresistentes (MDR) e a complexidade de quadros como a sepse nos compelem a expandir nosso campo de visão. A próxima fronteira no combate às IRAS reside na compreensão profunda e na modulação da resposta imune do próprio hospedeiro (Ref. 1). No epicentro dessa resposta está o Sistema Complemento, uma rede ancestral, poderosa e clinicamente decisiva de proteínas que constitui uma das primeiras e mais formidáveis linhas de defesa do organismo. Este artigo propõe uma questão central: e se a chave para o controle de infecções não estiver apenas em novos antibióticos, mas na modulação da nossa mais antiga linha de defesa?
Este artigo argumenta que uma compreensão sofisticada do sistema complemento — desde seus mecanismos bioquímicos fundamentais até sua subversão por patógenos nosocomiais e sua desregulação catastrófica na sepse — é indispensável para o profissional de controle de infecção moderno. Este conhecimento forma a base científica para um paradigma emergente e necessário: o “Imuno-Stewardship”. Ao longo deste texto, exploraremos os princípios fundamentais do complemento, sua relevância clínica evidenciada por deficiências genéticas, a corrida armamentista molecular travada com os principais patógenos hospitalares, o papel paradoxal do sistema na sepse e, finalmente, as futuras direções terapêuticas e estratégicas para a Comissão de Controle de Infecção Hospitalar (CCIH).
A Arquitetura da Defesa: Desvendando o Sistema Complemento
O Pilar da Imunidade Inata
O sistema complemento é uma rede complexa de mais de 60 proteínas plasmáticas e associadas à membrana, constituindo um braço da imunidade inata evolutivamente conservado e de ação rápida (Ref. 3). Longe de ser um mero coadjuvante, ele atua como uma ponte crucial entre a imunidade inata e a adaptativa, sendo essencial para a vigilância imunológica, a homeostase tecidual e a defesa contra patógenos (Ref. 3). Sua ativação desencadeia uma cascata enzimática com múltiplas funções efetoras, incluindo a opsonização de microrganismos para fagocitose, o recrutamento de células imunes para o local da infecção e a lise direta de certos patógenos (Ref. 3, 4).
As Três Vias de Ignição: Reconhecimento do “Não-Próprio”
A notável eficiência do sistema complemento reside em sua capacidade de ser ativado por múltiplos gatilhos, através de três vias distintas. Essa diversidade não representa mera redundância, mas sim uma estratégia de reconhecimento em camadas, garantindo uma resposta robusta a uma vasta gama de ameaças. Um patógeno emergente em ambiente hospitalar, para o qual ainda não existem anticorpos, pode ser prontamente reconhecido pelas outras vias, demonstrando um sistema de detecção à prova de falhas.
- Via Clássica: A via clássica é canonicamente ativada quando o complexo C1, especificamente sua subunidade de reconhecimento C1q, se liga a complexos antígeno-anticorpo (principalmente IgM e subclasses de IgG). Essa ligação desencadeia uma cascata proteolítica que culmina na formação de uma enzima chave, a C3 convertase. De forma não canônica, a via clássica também pode ser iniciada pela ligação direta de C1q a superfícies de células apoptóticas (eliminação de células anormais) ou a proteínas de fase aguda como a Proteína C Reativa (PCR), destacando seu papel tanto em infecções quanto em processos de inflamação estéril e limpeza tecidual.
- Via das Lectinas: Esta via funciona como um sistema de reconhecimento de padrões inato, independente de anticorpos. É iniciada quando moléculas de reconhecimento de padrões solúveis, como a Lectina de Ligação à Manose (MBL) e as ficolinas, se ligam a arranjos específicos de carboidratos (ex: manose, N-acetilglucosamina) presentes na superfície de microrganismos, mas ausentes nas células do hospedeiro. A MBL, estruturalmente análoga ao C1q, ativa serina proteases associadas (MASPs), que então clivam os mesmos substratos da via clássica para formar a C3 convertase. Esta via é de importância crítica em encontros primários com patógenos, especialmente em neonatos e pacientes imunocomprometidos.
- Via Alternativa: Diferente das outras, a via alternativa é constitutivamente ativa em um nível baixo, um processo conhecido como “tickover”, onde a proteína C3 sofre hidrólise espontânea para formar C3(H_{2}O). Isso a torna um sistema de vigilância constante. Em superfícies de células hospedeiras, proteínas reguladoras rapidamente inativam qualquer C3b depositado. No entanto, em superfícies de patógenos que carecem desses reguladores, o C3b depositado inicia um poderoso loop de amplificação, recrutando os Fatores B e D para formar mais C3 convertase da via alternativa (C3bBb). A properdina estabiliza essa convertase, intensificando massivamente a resposta. A via alternativa é, portanto, tanto um iniciador independente quanto o principal amplificador das outras duas vias.
O Ponto de Convergência e Amplificação: A Centralidade da C3 Convertase
Independentemente da via de iniciação, todas convergem para a formação de uma C3 convertase, uma enzima que cliva a proteína C3, a mais abundante do sistema, em dois fragmentos funcionalmente distintos: C3a e C3b. O C3a é uma potente anafilatoxina que promove a inflamação local (Ref. 5). O C3b, por sua vez, é o principal efetor. Ele possui uma ligação tioéster interna reativa que, ao ser exposta, permite que ele se ligue covalentemente a superfícies celulares próximas. Esta marcação covalente é o evento central da ativação do complemento, sinalizando o alvo como “não-próprio” e opsonizando-o para fagocitose. Além disso, o C3b se integra à C3 convertase para formar a C5 convertase, o passo seguinte na cascata.
O Golpe Final: O Complexo de Ataque à Membrana (MAC)
A C5 convertase cliva a proteína C5 em C5a, a anafilatoxina mais potente, e C5b. O C5b inicia a montagem da via terminal, recrutando sequencialmente as proteínas C6, C7, C8 e múltiplas cópias de C9. Este complexo, conhecido como Complexo de Ataque à Membrana (MAC ou C5b-9), se insere na membrana do patógeno-alvo, formando um poro transmembrana. Esse poro desregula o gradiente osmótico da célula, levando à sua lise e morte (Ref. 4). Embora a lise mediada pelo MAC seja um mecanismo de eliminação dramático e altamente eficaz contra certos patógenos, notadamente bactérias Gram-negativas como Neisseria meningitidis, é importante ressaltar que a opsonização por C3b e a inflamação mediada por C3a e C5a são funções efetoras igualmente, se não mais, cruciais na defesa contra a maioria dos microrganismos.
O Equilíbrio Delicado: Regulação Fisiológica e as Consequências da Disfunção
A potência da cascata do complemento exige um sistema de regulação rigoroso para prevenir danos aos tecidos do próprio hospedeiro. A falha nesse controle, seja por defeitos genéticos ou consumo excessivo, pode levar a doenças graves, oferecendo “experimentos da natureza” que revelam as funções essenciais e não redundantes de cada componente do sistema.
Protegendo o “Próprio”: Mecanismos de Regulação do Complemento
O sistema complemento é mantido sob controle por uma série de proteínas reguladoras solúveis e ligadas à membrana que atuam em pontos de verificação críticos. O Inibidor de C1 (C1-INH) previne a ativação espontânea da via clássica. As C3 convertases, o principal ponto de amplificação, são controladas por proteínas como o Fator H e a Proteína de Ligação a C4 (C4BP) no plasma, e pelo Fator Acelerador de Decaimento (DAF/CD55) e Proteína Cofatora de Membrana (MCP/CD46) nas superfícies celulares. Essas proteínas aceleram o decaimento das convertases ou atuam como cofatores para a clivagem e inativação de C3b e C4b pelo Fator I. A distinção entre “próprio” e “não-próprio” é exemplificada pela ação do Fator H, que se liga preferencialmente a polianíons como o ácido siálico, abundantes em células humanas, protegendo-as da amplificação da via alternativa. Na etapa final, a proteína CD59 impede a polimerização de C9, bloqueando a formação do MAC em células hospedeiras.
Experimentos da Natureza: Lições Clínicas das Deficiências do Complemento
As deficiências congênitas de componentes do complemento, embora raras, são modelos clínicos que ilustram vividamente o papel fisiológico de cada via e as vulnerabilidades específicas que surgem na sua ausência. O padrão de doenças infecciosas e autoimunes observado nesses pacientes funciona como uma “imagem negativa”, revelando os pontos de pressão que os patógenos bem-sucedidos evoluíram para explorar.
- Deficiências da Via Clássica (C1, C2, C4): Estão fortemente associadas ao desenvolvimento de doenças autoimunes, especialmente o Lúpus Eritematoso Sistêmico (LES) (Ref. 11). A prevalência do LES em indivíduos com deficiência de C1q chega a 93%. O mecanismo subjacente é a remoção ineficiente de células apoptóticas e de complexos imunes. Na ausência de uma opsonização adequada via via clássica, os detritos celulares e os complexos imunes persistem, tornando-se uma fonte de autoantígenos que impulsionam a resposta autoimune. Esses pacientes também apresentam maior suscetibilidade a infecções por bactérias encapsuladas como S. pneumoniae e H. influenzae (Ref. 11).
- Deficiências da Via Alternativa e Terminal (Properdina, C5-C9): A consequência mais marcante dessas deficiências é um aumento dramático, de até 10.000 vezes, no risco de infecções invasivas por espécies de Neisseria, principalmente N. meningitidis (Ref. 11). Este fato fornece a evidência clínica mais robusta da importância do MAC na defesa contra este grupo específico de patógenos. Paradoxalmente, a doença meningocócica nesses pacientes tende a ter um curso clínico mais brando e menor mortalidade. A hipótese para isso é que a ausência de lise bacteriana mediada pelo MAC resulta em uma menor liberação de endotoxina (lipopolissacarídeo – LPS) na circulação, atenuando a resposta inflamatória sistêmica que leva ao choque séptico.
- Deficiência de MBL: A deficiência da Lectina de Ligação à Manose está associada a uma maior suscetibilidade a infecções piogênicas recorrentes, especialmente em crianças pequenas (Ref. 11). Isso ressalta a importância da via das lectinas como uma primeira linha de defesa, crucial no período antes que a imunidade adaptativa e a produção de anticorpos estejam totalmente maduras.
A tabela a seguir resume as principais síndromes clínicas associadas a essas deficiências, servindo como uma ferramenta de referência rápida para o diagnóstico clínico.
Tabela 1: Síndromes Clínicas Associadas a Deficiências do Sistema Complemento
| Componente Deficiente | Via(s) Afetada(s) | Defeito Funcional Primário | Associações Clínicas Predominantes |
| C1q, C1r, C1s, C4, C2 | Clássica, Lectina | Comprometimento da remoção de imunocomplexos e células apoptóticas; ativação retardada do complemento. | Doenças do tecido conjuntivo (especialmente LES), infecções por bactérias encapsuladas (S. pneumoniae, H. influenzae). |
| MBL, Ficolinas, MASP-2 | Lectina | Comprometimento do reconhecimento de padrões de carboidratos microbianos e ativação inicial do complemento. | Infecções piogênicas recorrentes na infância, doença meningocócica. |
| Fator D, Properdina | Alternativa | Comprometimento da ativação do complemento na ausência de anticorpos e da alça de amplificação. | Infecções fulminantes por Neisseria meningitidis. |
| C3 | Todas as Vias | Defeitos graves em opsonofagocitose, quimiotaxia, remoção de imunocomplexos e atividade bactericida sérica. | Infecções piogênicas recorrentes e graves, doenças do tecido conjuntivo (LES, glomerulonefrite). |
| C5, C6, C7, C8 | Terminal | Ausência de atividade bactericida sérica (formação do MAC); quimiotaxia prejudicada (apenas C5). | Infecções recorrentes por Neisseria (principalmente meningocócica), geralmente com curso mais brando. |
| C1-INH (Inibidor de C1) | Regulação | Geração descontrolada de mediadores inflamatórios (bradicinina, fragmentos do complemento). | Angioedema Hereditário (AEH). |
| Fator H, Fator I | Regulação (Alternativa) | Ativação descontrolada da via alternativa, levando ao consumo de C3. | Síndrome Hemolítico-Urêmica atípica (SHUa), Glomerulonefrite Membranoproliferativa (GNMP), infecções recorrentes. |
| CD55 (DAF), CD59 | Regulação (Membrana) | Lise de células sanguíneas do hospedeiro por regulação inadequada de C3b e C8/C9. | Hemoglobinúria Paroxística Noturna (HPN). |
Fonte: Adaptado de Ram, S. (2020) e Ferreira et al. (2019) (Ref. 11).
O Campo de Batalha Molecular: Evasão do Complemento por Patógenos Nosocomiais
O ambiente hospitalar exerce uma pressão seletiva intensa, favorecendo não apenas microrganismos resistentes a antibióticos, mas também aqueles mais aptos a sobreviver à robusta resposta imune inata do hospedeiro. Um patógeno nosocomial bem-sucedido é, por definição, um mestre na evasão do sistema complemento (Ref. 2). A coevolução da resistência a múltiplos fármacos (MDR) e da evasão imune não é uma coincidência, mas um processo sinérgico. Frequentemente, os elementos genéticos móveis que conferem resistência a antibióticos são encontrados em linhagens bacterianas que também acumularam um arsenal de fatores de virulência para desarmar o complemento. Portanto, um fenótipo MDR em um isolado clínico deve alertar o profissional da CCIH para a alta probabilidade de um fenótipo de “alta virulência”, capaz de neutralizar a primeira linha de defesa do paciente, o que pode prenunciar desfechos clínicos piores.
Estratégias de Evasão dos Cocos Gram-Positivos
- Staphylococcus aureus: Este patógeno emprega uma estratégia multifacetada e redundante para neutralizar o complemento em quase todos os níveis da cascata (Ref. 2, 6).
- Inibição da Opsonização: A Proteína A estafilocócica (SpA) se liga à região Fc de anticorpos IgG de forma invertida, mascarando os sítios de ligação para C1q e impedindo a ativação da via clássica.
- Bloqueio da C3 Convertase: A proteína Inibidora do Complemento Estafilocócica (SCIN) se liga e estabiliza as C3 convertases de todas as vias em uma conformação inativa, bloqueando efetivamente o passo central de amplificação.
- Degradação Enzimática: S. aureus secreta um coquetel de proteases, como a metaloproteinase Aureolisina, que cliva e degrada diretamente o C3, criando um microambiente local livre de opsoninas (Ref. 6).
- Neutralização da Quimiotaxia: A Proteína Inibidora de Quimiotaxia de S. aureus (CHIPS) bloqueia o receptor de C5a (C5aR) nos neutrófilos, paralisando seu recrutamento para o local da infecção e criando um estado de “paralisia imune” local.
- Staphylococcus epidermidis: Embora menos invasivo que o S. aureus, sua principal estratégia de virulência é a formação de biofilme, especialmente em dispositivos médicos implantáveis. A matriz de substância polimérica extracelular (EPS) do biofilme atua como uma barreira física que impede o acesso dos componentes do complemento às células bacterianas. Isso resulta em deposição de C3b drasticamente reduzida, opsonização ineficaz e proteção contra a fagocitose, permitindo a persistência da infecção crônica (Ref. 7, 8).
As Fortalezas dos Bastonetes Gram-Negativos Multirresistentes (MDR)
- Klebsiella pneumoniae: A virulência deste patógeno está intrinsecamente ligada à sua espessa cápsula polissacarídica (CPS) (Ref. 10). A CPS funciona como um escudo físico que impede a inserção do MAC na membrana externa e mascara os padrões moleculares associados a patógenos (PAMPs) subjacentes, evitando o reconhecimento pela via das lectinas. A resistência ao complemento em K. pneumoniae resistente a carbapenêmicos (CRKP) é uma característica de virulência crucial, com estudos mostrando que a sobrevivência em soro humano depende da integridade da cápsula e do LPS.
- Pseudomonas aeruginosa: Este patógeno oportunista utiliza uma defesa de duas camadas (Ref. 9). Primeiramente, as longas cadeias do O-antígeno de seu lipopolissacarídeo (LPS) criam um impedimento estérico que distancia o MAC de alvos vulneráveis na membrana externa. Em segundo lugar, secreta ativamente proteases potentes, como a Protease Alcalina (AprA) e a Elastase B (LasB), que degradam uma ampla gama de componentes do complemento, incluindo C1q, C2 e C3, desmantelando a cascata antes que ela possa ser totalmente ativada (Ref. 9).
- Acinetobacter baumannii: Este patógeno de alta prioridade exibe uma notável diversidade em suas estratégias de evasão. Alguns isolados clínicos, frequentemente associados a tipos capsulares específicos (ex: KL171), inibem a ativação do complemento em etapas iniciais, prevenindo a deposição de C3b e MAC. Outros isolados permitem a montagem do MAC em sua superfície, mas impedem sua inserção funcional correta na membrana, tornando-o ineficaz. Essa inserção inadequada permite que a bactéria resista à lise, mesmo estando coberta pelo complexo terminal do complemento.
A tabela a seguir oferece um panorama comparativo das estratégias de evasão empregadas por esses importantes patógenos nosocomiais.
Tabela 2: Mecanismos de Evasão do Complemento por Patógenos Nosocomiais Relevantes
| Patógeno | Mecanismo de Evasão | Molécula(s) Efetora(s) | Alvo no Complemento |
| Staphylococcus aureus | Inibição da via clássica | Proteína A (SpA) | C1q (via ligação ao Fc de IgG) |
| Inibição da C3 Convertase | SCIN (Inibidor do Complemento Estafilocócico) | C3 convertases (todas as vias) | |
| Degradação enzimática | Aureolisina, Protease V8 | C3, C5 | |
| Bloqueio da quimiotaxia | CHIPS | Receptor de C5a (C5aR) | |
| Staphylococcus epidermidis | Barreira física | Biofilme (matriz de EPS) | Todos os componentes (acesso impedido) |
| Klebsiella pneumoniae | Escudo físico, mascaramento | Cápsula Polissacarídica (CPS) | MAC (inserção bloqueada), PAMPs (reconhecimento impedido) |
| Modificação do LPS | O-antígeno | MAC (alvo distanciado) | |
| Pseudomonas aeruginosa | Degradação enzimática | Protease Alcalina (AprA), Elastase (LasB) | C1q, C2, C3, C5a |
| Impedimento estérico | O-antígeno longo do LPS | MAC (alvo distanciado) | |
| Acinetobacter baumannii | Inibição da via alternativa | Fatores de superfície (associados à cápsula) | Ativação da via alternativa |
| Prevenção da inserção do MAC | Estruturas da membrana externa | Inserção funcional do C5b-9 |
Fonte: Compilado de Lambris et al. (2008) (Ref. 2), Jusko et al. (2013) (Ref. 6), González-Alsina et al. (2023) (Ref. 9), Zierke et al. (2025) (Ref. 10).
A Tempestade Perfeita: O Papel Ambíguo do Complemento na Sepse e na Doença Crítica
A sepse representa a resposta desregulada do hospedeiro a uma infecção, levando a uma disfunção orgânica potencialmente fatal. Nesse cenário, o sistema complemento desempenha um papel paradoxal e central: é uma faca de dois gumes. Enquanto sua ativação é absolutamente essencial para o controle inicial do patógeno, sua ativação sistêmica e descontrolada torna-se um dos principais motores da lesão tecidual e da falência de múltiplos órgãos (FMO) que caracterizam o choque séptico (Ref. 4). A fisiopatologia da sepse pode ser, em grande parte, redefinida como uma falha catastrófica na regulação do complemento. Em uma infecção localizada, a ativação é intensa, mas contida. Na sepse, a disseminação sistêmica do patógeno ou de seus produtos sobrecarrega a capacidade dos inibidores fisiológicos, como o Fator H e o C1-INH, resultando em um ciclo vicioso de amplificação descontrolada.
C5a: O Maestro da Hiperinflamação
No centro da tempestade inflamatória da sepse está a anafilatoxina C5a (Ref. 4). Níveis excessivos de C5a, gerados pela ativação maciça do complemento, orquestram uma resposta inflamatória deletéria. O C5a é um dos mais potentes quimioatraentes para neutrófilos e monócitos, promovendo seu recrutamento massivo para os tecidos. Uma vez ativadas pelo C5a, essas células liberam enzimas proteolíticas, espécies reativas de oxigênio e contribuem para a formação de redes extracelulares de neutrófilos (NETs), causando dano tecidual colateral significativo. Além disso, o C5a induz a liberação de citocinas pró-inflamatórias, aumenta a permeabilidade vascular e ativa a cascata de coagulação, contribuindo para a coagulação intravascular disseminada (CIVD) e a formação de microtrombos.
Da Resposta Local à Falência de Múltiplos Órgãos (FMO)
A hiperinflamação sistêmica impulsionada pelo C5a é o elo direto entre a infecção e a disfunção de órgãos vitais. No pulmão, o acúmulo de neutrófilos ativados e o aumento da permeabilidade vascular levam à Síndrome do Desconforto Respiratório Agudo (SDRA). Nos rins, a inflamação e a microtrombose contribuem para a lesão renal aguda. O sistema cardiovascular é afetado por uma depressão miocárdica e vasodilatação profunda, resultando em choque refratário. Estudos experimentais demonstraram conclusivamente que o bloqueio do C5a ou de seu receptor (C5aR) pode prevenir ou atenuar a FMO e melhorar a sobrevida em modelos de sepse, confirmando seu papel patogênico central (Ref. 4).
Biomarcadores e Prognóstico
A magnitude da ativação do complemento reflete a gravidade da sepse. Estudos clínicos mostraram que níveis elevados de produtos de ativação do complemento, como C3a, C5a e o complexo terminal solúvel sC5b-9, no plasma de pacientes sépticos, correlacionam-se com a gravidade da disfunção orgânica e são preditores de mortalidade (Ref. 5). Em infecções por bactérias Gram-negativas, níveis baixos de C3 e C4, indicando consumo excessivo, foram associados a choque séptico e maior mortalidade, ressaltando o papel protetor inicial desses componentes (Ref. 5). Esses achados sugerem que a monitorização da ativação do complemento pode ter valor prognóstico e ajudar a estratificar pacientes de alto risco.
Modulando a Cascata: Implicações Terapêuticas e o Futuro do Controle de Infecção
O entendimento do papel central do complemento na saúde e na doença abriu caminho para uma nova classe de terapias: os moduladores do complemento. O desenvolvimento desses fármacos representa uma mudança de paradigma, movendo o foco de terapias anti-infecciosas (que visam o patógeno) para terapias direcionadas ao hospedeiro (que visam controlar a resposta inflamatória). Esta evolução tem implicações profundas e diretas para a CCIH, cujo papel deve se expandir do gerenciamento de antibióticos para o manejo de imunodeficiências iatrogênicas e a compreensão da interação entre fármacos imunomoduladores e o risco de infecção.
A Terapia Anti-Complemento: Uma Nova Ferramenta no Arsenal Clínico
- Inibição de C5 (Eculizumabe): O eculizumabe é um anticorpo monoclonal humanizado que se liga à proteína C5, impedindo sua clivagem em C5a e C5b. Ao bloquear a C5, ele inibe tanto a geração da potente anafilatoxina C5a quanto a formação do MAC. É aprovado para o tratamento de doenças como a Hemoglobinúria Paroxística Noturna (HPN) e a Síndrome Hemolítico-Urêmica atípica (SHUa). A implicação para a CCIH é crítica: pacientes em uso de eculizumabe são funcionalmente deficientes em componentes terminais do complemento e, como tal, apresentam um risco drasticamente aumentado de infecções meningocócicas invasivas (Ref. 11). A vacinação contra meningococos (sorogrupos ACWY e B) é mandatória, e um alto índice de suspeita para infecções por bactérias encapsuladas deve ser mantido.
- Inibição de C5a (Vilobelimabe): Em vez de bloquear toda a via terminal, o vilobelimabe é um anticorpo monoclonal que se liga e neutraliza especificamente a anafilatoxina C5a, deixando a formação do MAC (C5b-9) intacta. Esta abordagem mais direcionada visa controlar a hiperinflamação mediada pelo C5a, preservando a capacidade de lise bacteriana do MAC. O ensaio clínico de fase 3 PANAMO demonstrou um benefício de mortalidade significativo com o vilobelimabe em pacientes com COVID-19 grave sob ventilação mecânica, fornecendo uma prova de conceito clínica para o bloqueio do C5a na sepse viral (Ref. 12). Um estudo anterior de fase IIa (SCIENS) em sepse bacteriana demonstrou que o fármaco era seguro e atingia seu alvo, embora não tenha mostrado diferença na mortalidade, destacando os desafios de tempo de intervenção e heterogeneidade dos pacientes em ensaios de sepse (Ref. 13).
- Inibição do Receptor de C5a (C5aR) (Avdoralimabe): Uma estratégia alternativa é bloquear o sinal do C5a em seu receptor celular, o C5aR. O avdoralimabe é um anticorpo monoclonal que bloqueia o C5aR, impedindo a ativação celular induzida pelo C5a, ao mesmo tempo que preserva a formação do MAC. Esta abordagem está sendo investigada em diversas condições inflamatórias, incluindo pneumonia grave, representando outra via para modular a resposta inflamatória excessiva na doença crítica.
Implicações para a CCIH
A crescente utilização de inibidores do complemento está criando uma nova população de pacientes iatrogenicamente imunocomprometidos com um perfil de risco de infecção específico e previsível. É imperativo que a CCIH desenvolva e implemente protocolos robustos para a triagem, vacinação, profilaxia e manejo de infecções nesses indivíduos. Compreender o alvo específico de cada fármaco (C5 vs. C5a/C5aR) é crucial, pois a ablação da formação do MAC pode ter implicações diferentes para a atividade bactericida em comparação com o controle da inflamação.
Conclusões e Recomendações: Rumo ao “Imuno-Stewardship”
A jornada desde a arquitetura fundamental do sistema complemento até seu papel como um campo de batalha decisivo nas IRAS e na sepse revela verdades inegáveis. Patógenos nosocomiais bem-sucedidos são, por natureza, especialistas em evasão do complemento, e a ativação descontrolada deste sistema é um motor primário de mortalidade em pacientes críticos. A era de focar exclusivamente no patógeno está chegando a um limite; o futuro do controle de infecções exige uma abordagem que integre o hospedeiro na equação.
Propõe-se formalmente o conceito de “Imuno-Stewardship” como uma abordagem proativa e centrada no hospedeiro para a prevenção e manejo de infecções, representando a evolução necessária do Antimicrobial Stewardship (Ref. 1). Este novo paradigma não substitui o anterior, mas o complementa, reconhecendo que o desfecho de uma infecção é determinado tanto pela virulência do patógeno quanto pela competência e regulação da resposta imune do paciente.
Recomendações para a Prática Clínica e para a CCIH
- Educação Continuada: A CCIH deve assumir a liderança na educação de todos os profissionais de saúde sobre os fundamentos da imunologia do hospedeiro, com ênfase no sistema complemento, seus mecanismos de ação e sua relevância clínica nas IRAS e na sepse.
- Vigilância Imunológica: Implementar protocolos de vigilância ativa para pacientes em uso de inibidores do complemento ou outras terapias imunomoduladoras. Isso deve incluir a verificação do status vacinal, a prescrição de profilaxia antimicrobiana quando indicada e a criação de alertas clínicos para um diagnóstico rápido em caso de suspeita de infecção.
- Apoio Diagnóstico: Em colaboração com laboratórios clínicos, considerar a avaliação da função do complemento (ex: CH50, AH50) em pacientes com infecções recorrentes e inexplicadas por bactérias encapsuladas ou com apresentações atípicas de sepse, pois uma deficiência subjacente pode estar presente.
- Pesquisa Translacional: Fomentar a pesquisa dentro da instituição para correlacionar o status imunológico do paciente (incluindo marcadores de ativação do complemento) com o risco, a etiologia e o desfecho das IRAS. Isso pode ajudar a identificar pacientes de alto risco que poderiam se beneficiar de estratégias de prevenção mais intensivas ou de terapias direcionadas ao hospedeiro.
A luta contra as infecções hospitalares está entrando em uma nova era, onde gerenciar a paisagem imunológica do paciente será tão crítico quanto selecionar o antibiótico correto. Ao abraçar a complexidade de sistemas como o complemento, a CCIH pode liderar o caminho para uma abordagem mais personalizada, precisa e eficaz para a segurança do paciente.
O Sistema Complemento é muito mais do que um mecanismo bioquímico: é o ponto de encontro entre defesa, inflamação e patologia. Sua ativação controlada protege contra microrganismos; sua desregulação, no entanto, impulsiona a falência orgânica e a mortalidade em sepse. Patógenos nosocomiais de alta prioridade, como S. aureus, P. aeruginosa e K. pneumoniae, são especialistas em neutralizar essa linha de defesa, tornando-se ainda mais ameaçadores
Por isso, o futuro do controle de infecção hospitalar exige que avancemos do Antimicrobial Stewardship para o Imuno-Stewardship — integrando vigilância imunológica, educação dos profissionais e novas terapias direcionadas ao hospedeiro. Somente assim poderemos transformar a imunidade do paciente em aliada decisiva na luta contra as IRAS.
Referências bibliográficas
- CCIH.MED.BR. O neutrófilo na linha de fogo do combate ao patógeno: a disfunção que ameaça a vida. Disponível em: https://www.ccih.med.br/o-neutrofilo-na-linha-de-fogo-do-combate-ao-patogeno-a-disfuncao-que-ameaca-a-vida/. Acesso em: 15 out. 2024.
- Resumo: Este artigo do portal CCIH.med.br introduz o conceito de “Imuno-Stewardship”, argumentando que o futuro do controle de infecções reside na compreensão e modulação da resposta imune inata do hospedeiro, particularmente a função dos neutrófilos, como um complemento essencial ao gerenciamento de antimicrobianos.
- LAMBRIS, John D.; RICKLIN, Daniel; GEISBRECHT, Brian V. Complement evasion by human pathogens. Nature Reviews Microbiology, v. 6, n. 2, p. 132-142, fev. 2008.
- Resumo: Esta revisão fundamental oferece uma visão abrangente das estratégias moleculares utilizadas por diversos patógenos para evadir o sistema complemento. Os mecanismos são categorizados em recrutamento de reguladores do hospedeiro, mimetismo molecular e degradação enzimática, sendo fundamental para compreender a corrida armamentista entre hospedeiro e patógeno.
- DOI: https://doi.org/10.1038/nrmicro1824
- SAHU, Sanjaya K. et al. Emerging roles of the complement system in host-pathogen interactions. Trends in Microbiology, v. 30, n. 4, p. 390-402, set. 2021.
- Resumo: Este artigo discute os papéis expandidos do sistema complemento para além da defesa intravascular, destacando a importância da ativação local e intracelular. Detalha como os patógenos são reconhecidos e como eles subvertem essas vias recém-compreendidas, fornecendo uma perspectiva moderna sobre a função do complemento na infecção.
- DOI: https://doi.org/10.1016/j.tim.2021.09.002
- RITTIRSCH, Daniel; REDL, Heinz; HUBER-LANG, Markus. Role of Complement in Multiorgan Failure. Clinical and Developmental Immunology, v. 2012, p. 962927, dez. 2012.
- Resumo: Esta revisão foca no papel deletério da ativação descontrolada do complemento, especialmente do C5a, na patogênese da sepse e da síndrome da resposta inflamatória sistêmica (SIRS). Detalha como o complemento contribui para a disfunção de órgãos-chave, sendo uma peça central para entender a falência de múltiplos órgãos induzida pela sepse.
- DOI: https://doi.org/10.1155/2012/962927
- EICHENBERGER, Emily M. et al. Complement levels in patients with bloodstream infection due to Staphylococcus aureus or Gram-negative bacteria. European Journal of Clinical Microbiology & Infectious Diseases, v. 39, n. 11, p. 2121–2131, jul. 2020.
- Resumo: Este estudo clínico investigou a associação entre os níveis de componentes do complemento e os desfechos em pacientes com bacteremia. Encontrou que níveis baixos de C3 e C4 estavam ligados ao choque séptico e à mortalidade em infecções por Gram-negativos, enquanto níveis elevados de C5a eram proeminentes na bacteremia por S. aureus, sugerindo perfis de complemento e interações patogênicas distintas.
- DOI: https://doi.org/10.1007/s10096-020-03955-z
- JUSKO, Monika et al. Staphylococcal Proteases Aid in Evasion of the Human Complement System. Journal of Innate Immunity, v. 6, n. 1, p. 31-46, jul. 2013.
- Resumo: Este estudo detalha os mecanismos específicos pelos quais as proteases extracelulares de S. aureus (Aureolisina, V8, Estafopaínas) degradam componentes-chave do complemento como C3 e C5. Demonstra que essa atividade proteolítica é um importante fator de virulência que inibe a opsonização e contribui para a sobrevivência do patógeno no sangue humano.
- DOI: https://doi.org/10.1159/000351458
- GRANSLO, Hildegunn N. et al. Staphylococcus epidermidis biofilms induce lower complement activation in neonates as compared with adults. Pediatric Research, v. 73, n. 3, p. 294-300, dez. 2012.
- Resumo: Este estudo destaca a deficiência maturacional do sistema complemento neonatal. Mostra que os biofilmes de S. epidermidis, uma causa importante de sepse neonatal, induzem uma ativação mais fraca do complemento no sangue do cordão umbilical em comparação com o sangue de adultos, explicando potencialmente a maior suscetibilidade dos recém-nascidos a essas infecções.
- DOI: https://doi.org/10.1038/pr.2012.193
- DOMENECH, Mirian et al. Biofilm Formation Avoids Complement Immunity and Phagocytosis of Streptococcus pneumoniae. Infection and Immunity, v. 81, n. 7, p. 2606–2615, jul. 2013.
- Resumo: Esta pesquisa demonstra que S. pneumoniae crescendo em estado de biofilme evade eficazmente o sistema imune. A matriz do biofilme prejudica a deposição de componentes-chave do complemento (C3b, C1q) enquanto aumenta o recrutamento do inibidor Fator H, levando à redução da opsonização e à fagocitose prejudicada por neutrófilos.
- DOI: https://doi.org/10.1128/IAI.00491-13
- GONZÁLEZ-ALSINA, Alex et al. Pseudomonas aeruginosa and the Complement System: A Review of the Evasion Strategies. Microorganisms, v. 11, n. 3, p. 664, mar. 2023.
- Resumo: Este artigo de revisão categoriza sistematicamente os mecanismos de evasão do complemento de P. aeruginosa. Detalha como o patógeno utiliza seu O-antígeno do LPS como um escudo estérico e secreta proteases (LasB, AprA) para degradar proteínas do complemento, fornecendo um quadro claro de sua defesa multifacetada contra a imunidade inata.
- DOI: https://doi.org/10.3390/microorganisms11030664
- ZIERKE, Lisa et al. Influence of the polysaccharide capsule on virulence and fitness of Klebsiella pneumoniae. Frontiers in Microbiology, v. 16, 6 fev. 2025.
- Resumo: Este artigo ressalta o papel crítico da cápsula polissacarídica (CPS) como o principal fator de virulência de K. pneumoniae. Demonstra que a cápsula é essencial para a sobrevivência no sangue humano, protegendo a bactéria da opsonização e morte mediadas pelo complemento, e assim, prevenindo a fagocitose.
- DOI: https://doi.org/10.3389/fmicb.2025.1450984
- FERREIRA, Ana Cláudia Goulart et al. Doenças associadas à deficiência do sistema complemento. Archives of Health Sciences, v. 26, n. 1, p. 62-66, 28 ago. 2019.
- Resumo: Esta revisão narrativa resume as principais doenças associadas a deficiências do complemento, tanto hereditárias quanto adquiridas. Conecta deficiências específicas a condições como lúpus, SHUa e aumento da suscetibilidade a infecções, reforçando a importância clínica de um sistema complemento funcional para a homeostase e defesa.
- Link: https://pesquisa.bvsalud.org/portal/resource/pt/biblio-1046127
- VLAAR, Alexander P. J. et al. Anti-C5a antibody (vilobelimab) therapy for critically ill, invasively mechanically ventilated patients with COVID-19 (PANAMO): a multicentre, double-blind, randomised, placebo-controlled, phase 3 trial. The Lancet Respiratory Medicine, v. 10, n. 12, p. 1137-1146, dez. 2022.
- Resumo: Esta publicação relata os resultados do ensaio de fase 3 PANAMO, que descobriu que o vilobelimabe, um anticorpo anti-C5a, reduziu significativamente a mortalidade por todas as causas em 28 dias em pacientes com COVID-19 em estado crítico sob ventilação mecânica. Fornece evidências clínicas chave para o benefício terapêutico de visar a hiperinflamação impulsionada pelo C5a na sepse viral.
- DOI:((https://doi.org/10.1016/S2213-2600(22)00297-1))
- SKIBSTED, Simon et al. Efficacy and Safety of Vilobelimab (IFX-1), a Novel Monoclonal Anti-C5a Antibody, in Patients With Early Severe Sepsis or Septic Shock-A Randomized, Placebo-Controlled, Double-Blind, Multicenter, Phase IIa Trial (SCIENS Study). Critical Care Medicine, v. 49, n. 12, p. e1183-e1194, dez. 2021.
- Resumo: Este ensaio de fase IIa (SCIENS) avaliou a segurança e eficácia do vilobelimabe em pacientes com sepse bacteriana grave. O estudo demonstrou que o medicamento era seguro e neutralizava eficazmente o C5a de forma dose-dependente, sem prejudicar a formação do MAC. Embora nenhum benefício de mortalidade tenha sido observado, os resultados apoiam a segurança de visar o C5a nesta população.
- DOI: https://doi.org/10.1097/CCM.0000000000005221
Autor:
Antonio Tadeu Fernandes:
https://www.linkedin.com/in/mba-gest%C3%A3o-ccih-a-tadeu-fernandes-11275529/
https://www.instagram.com/tadeuccih/
#ControleDeInfecção #CCIH #Sepse #SistemaComplemento #SegurançaDoPaciente #ImunoStewardship #IRAS #choqueséptico
Instituto CCIH+ Parceria permanente entre você e os melhores professores na sua área de atuação
Conheça nossos cursos de especialização ou MBA:
MBA Gestão em Saúde e Controle de Infecção
MBA Gestão em Centro de Material e Esterilização
MBA EQS – Gestão da Segurança do Paciente e governança clínica
Especialização em Farmácia Clínica e Hospitalar
Pós-graduação em Farmácia Oncológica