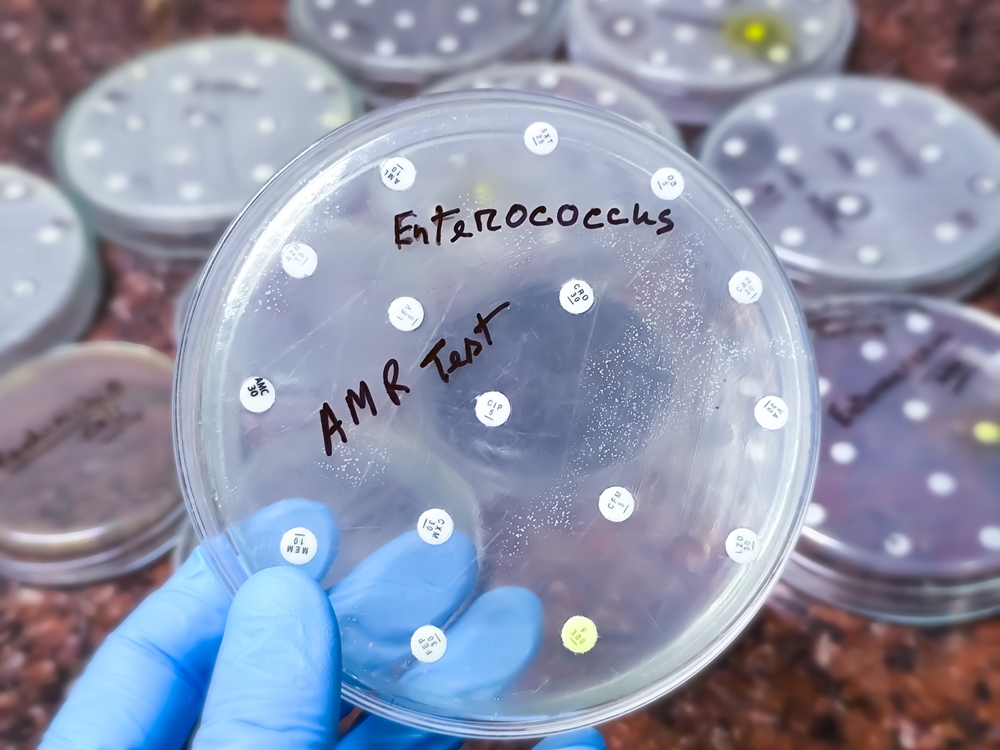
Streptococcus e Enterococcus deixaram de ser vilões previsíveis. Descubra como esses microrganismos evoluíram, desafiam o controle de infecção e exigem novas estratégias clínicas, diagnósticas e terapêuticas no ambiente hospitalar moderno. Leitura essencial para CCIH, infectologistas e gestores de saúde.
Resumo Crítico: Do Comensal à Superbactéria
Este artigo disseca o paradoxo evolutivo dos cocos Gram-positivos (Streptococcus e Enterococcus), desafiando a noção de que estes são microrganismos “velhos conhecidos” e de fácil manejo. O texto argumenta que a prática clínica contemporânea subestima a plasticidade genética destes patógenos, resultando em falhas terapêuticas e diagnósticas graves.
Pontos-Chave da Análise:
- A Ascensão do Enterococo: O artigo detalha como a perda do sistema CRISPR-Cas em linhagens hospitalares (como o Clado A1 de E. faecium) transformou estes organismos em “colecionadores de resistência” geneticamente promíscuos. Destaca-se a mudança de paradigmas terapêuticos, como o uso do sinergismo Ampicilina + Ceftriaxona para endocardite por E. faecalis (mesmo com resistência a aminoglicosídeos) e o “efeito gangorra” (seesaw effect) no uso de Daptomicina.
- Alertas de Virulência Oculta:
- S. gallolyticus e Oncologia: O texto estabelece a identificação deste microrganismo como um marcador sentinela obrigatório para o rastreio de câncer colorretal, devido à proteína Pil1 e seu papel na proliferação tumoral.
- S. anginosus e Abscessos: Define o isolamento desta bactéria no sangue como um “alerta vermelho” para a busca ativa de abscessos profundos, dada sua capacidade única de destruição tecidual via toxina Intermedilisina.
- S. pyogenes (GAS): Aborda o paradoxo da sensibilidade à penicilina versus a letalidade do Choque Tóxico, reforçando a necessidade da Clindamicina para bloquear a produção de superantígenos (Efeito Eagle).
- Stewardship e Diagnóstico: O material critica o tratamento de bacteriúria assintomática por enterococo e reforça o papel de tecnologias como MALDI-TOF e PCR multiplex para descalonamento rápido de antibióticos.
Conclusão: O artigo conclui que a batalha contra estes patógenos não se vence apenas com novos antibióticos, mas com inteligência diagnóstica, limpeza terminal agressiva (para VRE) e uma compreensão profunda da fisiopatologia que os livros básicos ignoram.
Índice do Artigo
Abaixo encontra-se a estrutura lógica do conteúdo para facilitar a navegação e leitura:
- Introdução: O Paradoxo da Persistência Microbiana
- O desafio dos cocos Gram-positivos na medicina moderna.
- O Gênero Enterococcus: De Comensais a “Superbactérias”
- 2.1. Uma Jornada Histórica e Taxonômica
- 2.2. Microbiologia e Identificação Fenotípica
- 2.3. Genômica Populacional (Clado A vs. B e perda de CRISPR-Cas)
- 2.4. Mecanismos de Virulência (Biofilme, Collagen Hug)
- 2.5. Resistência Antimicrobiana e Terapêutica
- 2.5.1. Resistência à Vancomicina (Fenótipos VanA, VanB, VanC)
- 2.5.2. Estratégias Avançadas (Ampicilina+Ceftriaxona, Daptomicina, Linezolida)
- Streptococcus pyogenes (Grupo A): A Virulência Persistente
- 3.1. A Proteína M e Classificação emm
- 3.2. Superantígenos e a Síndrome do Choque Tóxico
- 3.3. Complicações Autoimunes (Febre Reumática, PANDAS, GNPE)
- 3.4. Terapêutica e o “Efeito Eagle”
- Streptococcus agalactiae (Grupo B): Mudança de Paradigma
- 4.1. O Clone Hipervirulento CC17
- 4.2. O Peso da Doença no Adulto (Diabetes e Idosos)
- 4.3. Vacinação: A Fronteira Final
- Streptococcus pneumoniae: O Camaleão da Resistência
- 5.1. A Cápsula e a “Substituição de Sorotipo” pós-vacinal
- 5.2. Mecanismos de Resistência (PBPs) e Tratamento (Meningite vs. Pneumonia)
- O Grupo Streptococcus anginosus: Os Construtores de Abscessos
- 6.1. Taxonomia e Características
- 6.2. Fator Intermedilisina e Busca de Abscessos Ocultos
- Streptococcus gallolyticus: O Sentinela Oncológico
- A associação obrigatória com Câncer Colorretal e protocolos de colonoscopia.
- Os “Outros” Cocos: Raros mas Relevantes
- 8.1. Variantes Nutricionais (Abiotrophia, Granulicatella)
- 8.2. Leuconostoc e Pediococcus (Resistência intrínseca a Vanco)
- 8.3. Streptococcus suis (Meningite e Surdez)
- Stewardship de Antimicrobianos e Controle de Infecção
- 9.1. Diagnóstico Rápido (MALDI-TOF, PCR)
- 9.2. Prevenção de VRE (Limpeza terminal e Higiene das mãos)
- 9.3. Uso Racional de Antibióticos
- Conclusão
- A necessidade de evoluir intelectualmente para acompanhar a evolução bacteriana.
- Referências Bibliográficas
FAQ: Do Comensal à Superbactéria – Estratégias Clínicas para Streptococcus e Enterococcus
Este guia rápido foi elaborado para gestores hospitalares, membros da CCIH, médicos, farmacêuticos e enfermeiros, abordando os desafios críticos impostos por Streptococcus e Enterococcus no cenário atual de resistência antimicrobiana.
Mecanismos e Epidemiologia
1. Por que bactérias comensais como Streptococcus e Enterococcus estão se tornando “superbactérias”?
A transição de comensal para patógeno multirresistente ocorre devido à plasticidade genômica dessas bactérias. Elas possuem uma capacidade elevada de adquirir genes de resistência e virulência através de transferência horizontal (elementos genéticos móveis como plasmídeos e transposons) e recombinação homóloga, especialmente sob a pressão seletiva do uso de antimicrobianos.
- Referência Principal: Do comensal à superbactéria: Por que Streptococcus e Enterococcus exigem novas estratégias clínicas?
- Para saber mais: Estrutura molecular da resistência microbiana – CCIH
2. Qual é o impacto global da resistência dessas bactérias na mortalidade?
Estudos globais, como o publicado na The Lancet (2019), indicam que S. pneumoniae e Enterococcus faecium e faecalis estão entre os principais patógenos responsáveis por milhões de mortes associadas à resistência antimicrobiana (RAM), superando muitas doenças infecciosas clássicas.
- Referência: Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis (The Lancet)
- Artigo relacionado: A Pandemia Silenciosa em Alerta Máximo – CCIH
3. Qual a diferença clínica fundamental entre Enterococcus faecalis e Enterococcus faecium?
Embora o E. faecalis seja mais comum e virulento, ele geralmente permanece sensível à ampicilina. Já o E. faecium é o grande vilão da resistência hospitalar, apresentando frequentemente resistência à ampicilina e à vancomicina (VRE), exigindo terapias mais complexas.
Enterococcus e VRE (Vancomycin-Resistant Enterococcus)
4. Qual é o mecanismo molecular da resistência à vancomicina nos Enterococos (VRE)?
A resistência é mediada principalmente pelos genes vanA e vanB, que alteram o alvo do antibiótico na parede celular. Eles modificam a terminação do precursor do peptidoglicano de D-Alanina-D-Alanina para D-Alanina-D-Lactato, impedindo a ligação da vancomicina.
- Referência Técnica: Estrutura molecular da resistência microbiana – CCIH
5. Quais são as opções terapêuticas de primeira linha para infecções graves por VRE?
As opções principais incluem a Linezolida (oxazolidinona) e a Daptomicina (lipopeptídeo cíclico). A escolha depende do sítio da infecção (ex: daptomicina não deve ser usada em pneumonia) e do perfil de efeitos adversos.
- Referência Principal: Do comensal à superbactéria: Por que Streptococcus e Enterococcus exigem novas estratégias clínicas?
- Aprofundamento: Daptomicina em Altas Doses: A Nova Fronteira no Combate ao MRSA e VRE – CCIH
6. Qual a dosagem recomendada de Daptomicina para VRE, segundo novas evidências?
Para infecções graves por enterococos, doses padrão (4-6 mg/kg) podem ser insuficientes. Recomenda-se frequentemente o uso de altas doses (8-10 mg/kg ou até 12 mg/kg) para garantir eficácia bactericida e evitar resistência durante o tratamento.
7. O VRE exige precauções de contato? Por quanto tempo ele sobrevive no ambiente?
Sim, o VRE exige precauções de contato (luvas e avental) e, idealmente, quarto privativo. O enterococo é notoriamente resistente ao ambiente, podendo sobreviver em superfícies (grades de cama, equipamentos) por semanas ou meses, tornando a desinfecção terminal crucial.
- Referência: Enterococcus Resistente à Vancomicina (VRE) – seu hospital está sob esse risco? – CCIH
- Vídeo Recomendado: Limpeza e Desinfecção de Superfícies – Canal CCIH Cursos (YouTube)
Streptococcus (Pneumoniae e Pyogenes)
8. Como ocorre a resistência à penicilina no Streptococcus pneumoniae?
Diferente de outros organismos que produzem beta-lactamases, o pneumococo desenvolve resistência através da alteração das Proteínas Ligadoras de Penicilina (PBPs), criando “PBPs mosaico” que reduzem a afinidade do antibiótico.
- Referência Principal: Do comensal à superbactéria: Por que Streptococcus e Enterococcus exigem novas estratégias clínicas?
9. Qual o papel da vacinação no controle da resistência do S. pneumoniae?
As vacinas conjugadas pneumocócicas (PCV10, PCV13, PCV15, PCV20) reduzem a incidência de infecções invasivas e diminuem a circulação de sorotipos resistentes, reduzindo a necessidade de uso de antibióticos e a pressão seletiva (Efeito de Imunidade de Rebanho).
- Referência: Vacinação e controle de resistência bacteriana – Portal CCIH (Busca temática no site)
10. O que preocupa atualmente em relação ao Streptococcus pyogenes (Grupo A)?
Houve um ressurgimento de infecções invasivas graves (ex: Síndrome do Choque Tóxico Estreptocócico) e o surgimento de cepas com resistência a macrolídeos e clindamicina, complicando o tratamento em pacientes alérgicos à penicilina.
Diagnóstico e Stewardship
11. Como o diagnóstico rápido (ex: MALDI-TOF) impacta o tratamento dessas infecções?
A identificação rápida da espécie (diferenciar E. faecalis de E. faecium) permite iniciar a terapia correta dias antes dos métodos convencionais. Isso facilita o descalonamento da vancomicina ou linezolida para ampicilina se o isolado for um E. faecalis sensível.
- Referência: Diagnóstico rápido, decisão certa: a parceria que redefine o controle de infecções – CCIH
12. O que é a terapia de descalonamento para Gram-positivos?
É a prática de substituir um antibiótico de amplo espectro (como vancomicina ou linezolida) por um de espectro mais estreito (como oxacilina ou ampicilina) assim que os resultados de cultura e sensibilidade confirmam a suscetibilidade do patógeno.
- Referência: Terapia antimicrobiana sem segredos – CCIH
13. A Tigeciclina é uma boa opção para bacteremias por VRE?
A Tigeciclina tem atividade in vitro contra VRE, mas seu uso em bacteremias é controverso devido aos níveis séricos baixos que a droga atinge. É geralmente reservada para infecções intra-abdominais ou de pele/partes moles, ou como terapia combinada de resgate.
- Referência Principal: Do comensal à superbactéria: Por que Streptococcus e Enterococcus exigem novas estratégias clínicas?
14. Qual a importância da vigilância de colonização (swab retal) para VRE?
Identificar pacientes colonizados permite instituir precauções de contato precoces, evitando a disseminação horizontal dentro da unidade (surtos), especialmente em UTIs e unidades de transplante.
Controle de Infecção e Prevenção
15. A higiene das mãos com álcool gel é eficaz contra Enterococo e Estreptococo?
Sim, diferente do C. difficile (que forma esporos), o Enterococcus e o Streptococcus são suscetíveis ao álcool. A fricção antisséptica das mãos é a medida isolada mais eficaz para prevenir a transmissão cruzada.
- Vídeo Recomendado: Higiene das Mãos: Mitos e Verdades – Canal CCIH Cursos (YouTube)
16. O que é o conceito “One Health” (Saúde Única) aplicado a essas bactérias?
Reconhece que a resistência em Enterococcus e Streptococcus é impulsionada não apenas pelo uso humano de antibióticos, mas também pelo uso veterinário (pecuária) e contaminação ambiental, exigindo uma abordagem integrada para o controle.
- Referência Principal: Do comensal à superbactéria: Por que Streptococcus e Enterococcus exigem novas estratégias clínicas?
17. Como a CCIH deve atuar frente a um aumento de casos de VRE?
Deve-se realizar busca ativa de casos, reforçar a limpeza ambiental (usando desinfetantes adequados), auditar a adesão à higiene das mãos e uso de EPIs, e revisar o uso de antimicrobianos (especialmente cefalosporinas e vancomicina, que selecionam VRE).
18. Existem novas drogas no horizonte para tratar essas bactérias?
Sim, novos agentes como Oritavancina e Dalbavancina (lipoglicopeptídeos de longa duração) mostram eficácia contra Gram-positivos resistentes, incluindo VRE (algumas cepas) e MRSA, facilitando a desospitalização.
- Referência: Vancomicina e derivados: A Era do AUC/MIC – CCIH
19. Qual o papel da Clorexidina no banho de pacientes?
O banho diário com clorexidina em UTIs pode reduzir a carga de colonização cutânea por VRE e MRSA, diminuindo o risco de infecção de corrente sanguínea e transmissão cruzada.
- Referência: Medidas de prevenção de infecção primária de corrente sanguínea – CCIH (Protocolos de Prevenção)
20. Onde posso encontrar cursos de aprofundamento sobre este tema?
O Instituto CCIH+ oferece treinamentos completos sobre Antimicrobial Stewardship e Controle de Infecção, abordando profundamente a gestão de Gram-positivos multirresistentes.
- Conheça nossos cursos: www.ccih.med.br e nosso canal no YouTube.
Introdução: O Paradoxo da Persistência Microbiana
Na vasta tapeçaria da microbiologia clínica, poucos grupos de organismos desafiam a lógica médica contemporânea de forma tão persistente quanto os cocos Gram-positivos catalase-negativos (ref. 1). Para o profissional de saúde especializado — seja o infectologista, o gestor de controle de infecção (CCIH), o farmacêutico clínico ou o microbiologista — os gêneros Streptococcus e Enterococcus representam uma dualidade fascinante e perigosa (ref. 2).
Eles são, simultaneamente, comensais benignos que coexistem conosco desde o nascimento e patógenos oportunistas capazes de uma virulência fulminante (ref. 3). A persistência destes organismos, apesar de décadas de desenvolvimento farmacológico, exige uma reflexão crítica. Como pode o Streptococcus pyogenes, universalmente sensível à penicilina in vitro, continuar a matar milhares de pessoas anualmente através da fasciíte necrosante e da síndrome do choque tóxico? (ref. 4). Como os enterococos, historicamente descartados como organismos de baixa virulência, ascenderam à posição de protagonistas nas infecções associadas aos cuidados de saúde, acumulando genes de resistência como quem coleciona troféus evolutivos? (ref. 5).
A resposta reside na plasticidade genética, na adaptação ecológica e, crucialmente, nas lacunas da nossa própria vigilância e prática assistencial (ref. 6). A epidemiologia destes patógenos não é estática; ela flui com as mudanças demográficas da sociedade. O envelhecimento populacional, a epidemia de diabetes e a complexidade crescente das intervenções médicas criaram novos nichos para organismos como o Streptococcus agalactiae e o Streptococcus anginosus, que outrora ocupavam notas de rodapé nos manuais de medicina (ref. 7).
Este relatório técnico-científico destina-se a dissecar, com rigor acadêmico e profundidade granular, a biologia, a patogênese, o diagnóstico e o manejo destes microrganismos. Utilizando as evidências mais atuais, exploraremos não apenas o “o quê”, mas o “porquê” e o “como” das infecções estreptocócicas e enterocócicas, fornecendo subsídios para uma governança clínica de excelência e um stewardship de antimicrobianos robusto (ref. 8).
1. O Gênero Enterococcus: De Comensais Intestinais a “Superbactérias” Nosocomiais
1.1. Uma Jornada Histórica e Taxonômica
A compreensão moderna dos enterococos exige um olhar retrospectivo. O termo “entérocoque” surgiu na literatura francesa em 1899, cunhado por Thiercelin para descrever um diplococo intestinal potencialmente patogênico (ref. 9). No entanto, durante grande parte do século XX, estes organismos viveram sob a sombra taxonômica do gênero Streptococcus. Foi Sherman, em 1937, quem propôs uma classificação que agrupava os estreptococos pela sua tolerância a condições adversas, identificando os “enterococos” (então Streptococcus faecalis e outros) pela sua capacidade de crescer a 10°C e 45°C, em pH 9,6 e em altas concentrações de sal (6,5% NaCl) (ref. 10).
Somente em 1984, com os estudos de hibridização de ácidos nucleicos de Schleifer e Kilpper-Balz, o gênero Enterococcus foi formalmente separado dos Streptococcus (ref. 11). Esta distinção não foi apenas semântica; ela reconheceu uma divergência evolutiva profunda. Estudos genômicos recentes sugerem que os ancestrais dos enterococos modernos surgiram há centenas de milhões de anos, desenvolvendo durante a evolução dos vertebrados terrestres uma resistência intrínseca (“hardiness”) para sobreviver à dessecação e à inanição fora do hospedeiro, características que hoje os tornam patógenos nosocomiais formidáveis (ref. 12).
1.2. Microbiologia e Identificação Fenotípica
Os enterococos são cocos Gram-positivos, facultativamente anaeróbios, que se apresentam em pares ou cadeias curtas, morfologicamente indistinguíveis do Streptococcus pneumoniae em colorações de Gram diretas de hemoculturas (ref. 13). As duas espécies de maior relevância clínica, Enterococcus faecalis e Enterococcus faecium, dominam o cenário, mas espécies como E. gallinarum, E. casseliflavus e E. raffinosus surgem ocasionalmente.
A identificação laboratorial baseia-se na sua robustez fisiológica. Diferente dos estreptococos viridans, os enterococos hidrolisam a esculina na presença de 40% de sais biliares e são PYR (pirrolidonil arilamidase) positivos (ref. 14). A distinção entre E. faecalis e E. faecium é vital para o stewardship, pois dita a escolha empírica do antibiótico (Tabela 1). O E. faecalis fermenta piruvato e geralmente não fermenta arabinose, enquanto o E. faecium tipicamente fermenta arabinose e não utiliza piruvato (ref. 15).
1.3. Genômica Populacional e Evolução Nosocomial
A análise genômica revelou uma bifurcação evolutiva crítica no E. faecium. Existem dois clados ancestrais distintos: o Clado B, composto majoritariamente por cepas comensais humanas, e o Clado A, associado a animais e ambientes hospitalares (ref. 16). Dentro do Clado A, emergiu o sub-clado A1, uma linhagem especificamente adaptada ao ambiente hospitalar. Estas cepas “hospitalares” distinguem-se pela presença de elementos genéticos móveis, sequências de inserção (como IS16) e, crucialmente, mutações no gene pbp5 que conferem resistência à ampicilina (ref. 17).
Um achado genômico perturbador é a ausência do sistema CRISPR-Cas em muitas cepas multirresistentes de E. faecalis (como a cepa V583) e E. faecium (ref. 18). O sistema CRISPR-Cas atua como um “sistema imune” bacteriano contra DNA exogéneo (bacteriófagos, plasmídeos). A perda deste sistema permitiu que os enterococos hospitalares se tornassem “promíscuos” geneticamente, adquirindo facilmente plasmídeos de resistência e ilhas de patogenicidade sem restrições (ref. 19).
1.4. Mecanismos de Virulência: Aderência e Biofilme
A virulência enterocócica não se baseia em toxinas potentes como as do S. pyogenes, mas sim na persistência e aderência (ref. 20).
- Agregating Substance (AS): Proteínas codificadas por plasmídeos responsivos a feromônios que facilitam a agregação bacteriana e a troca de material genético, além de promoverem a aderência ao epitélio do hospedeiro (ref. 21).
- Esp (Enterococcal Surface Protein): Uma proteína de superfície gigante, homóloga à proteína Rib do GBS, que promove a formação de biofilme e está fortemente associada a cepas epidêmicas de E. faecium (ref. 22).
- Ace e Acm (Adesinas de Colágeno): O E. faecalis possui a proteína Ace e o E. faecium a proteína Acm. Ambas aderem ao colágeno tipo I e IV através do mecanismo “Collagen Hug” (abraço de colágeno), essencial para a colonização das válvulas cardíacas na endocardite (ref. 23).
- Pili (Ebp): Os pili associados a endocardite e biofilme (Ebp) são estruturas capilares na superfície celular que mediam a aderência às plaquetas e ao fibrinogênio, facilitando a formação de vegetações (ref. 24).
- Regulação por fsr e AsrR: O sistema fsr (semelhante ao agr do S. aureus) regula a expressão de proteases como a gelatinase (GelE), que degrada tecidos do hospedeiro (ref. 25). O regulador AsrR detecta o estresse oxidativo e, quando inativado, aumenta a expressão de fatores de virulência e resistência a antimicrobianos, sugerindo uma adaptação ao ambiente hostil dentro do fagócito (ref. 26).
1.5. Resistência Antimicrobiana: O Desafio Terapêutico
Os enterococos são notoriamente difíceis de tratar devido à sua resistência intrínseca e adquirida. Eles são intrinsecamente resistentes a cefalosporinas (devido à baixa afinidade das PBPs), clindamicina e sulfametoxazol-trimetoprima in vivo (capacidade de utilizar folato exógeno) (ref. 27).
1.5.1. Resistência à Vancomicina (VRE)
A resistência à vancomicina é mediada pela alteração do alvo na parede celular. O precursor normal do peptidoglicano termina em D-Alanina-D-Alanina, o sítio de ligação da vancomicina. Os operons van alteram este terminal para D-Alanina-D-Lactato (resultando em alta resistência) ou D-Alanina-D-Serina (baixa resistência), reduzindo a afinidade do antibiótico em 1000 vezes ou mais (ref. 28).
- Fenótipo VanA: Resistência de alto nível induzível à vancomicina e teicoplanina. É o tipo mais comum e problemático clinicamente, mediado pelo transposon Tn1546 (ref. 29).
- Fenótipo VanB: Resistência induzível à vancomicina, mas sensibilidade mantida à teicoplanina in vitro (ref. 30).
- Fenótipo VanC: Resistência intrínseca de baixo nível, constitutiva, encontrada em E. gallinarum e E. casseliflavus (produz D-Ala-D-Serina). Clinicamente menos relevante, mas pode causar confusão diagnóstica (ref. 31).
1.5.2. Estratégias Terapêuticas Avançadas
- Endocardite por E. faecalis: A combinação clássica é Ampicilina + Gentamicina (sinergismo para efeito bactericida). No entanto, devido à nefrotoxicidade e à crescente resistência de alto nível a aminoglicosídeos (HLAR), a combinação Ampicilina + Ceftriaxona tornou-se a terapia de escolha para muitas cepas HLAR (ref. 32). O mecanismo envolve a saturação complementar de diferentes proteínas ligadoras de penicilina (PBPs) pelos dois antibióticos, resultando em lise celular sinérgica, um fenômeno particularmente eficaz contra E. faecalis (ref. 33).
- VRE (E. faecium): As opções são limitadas. A Daptomicina é bactericida, mas requer doses elevadas (8-12 mg/kg ou mais) para eficácia e prevenção de resistência (ref. 34). Mutações no sistema liaFSR podem levar à resistência à daptomicina durante a terapia. O “efeito gangorra” (seesaw effect), originalmente descrito em MRSA e agora investigado em enterococos, sugere que o desenvolvimento de resistência à daptomicina pode, em alguns casos, restaurar a suscetibilidade aos beta-lactâmicos, abrindo portas para terapias combinadas de resgate (ref. 35). A Linezolida é uma opção oral, mas é bacteriostática, o que limita seu uso em endocardites graves e bacteremias profundas. A resistência à linezolida, mediada pelo gene cfr (que metila o rRNA 23S) ou pelos genes optrA e poxtA (proteção ribossômica), é uma ameaça emergente preocupante (ref. 36).
2. Streptococcus pyogenes (Grupo A): A Virulência Persistente
O Streptococcus pyogenes (GAS) permanece um paradoxo. É universalmente sensível à penicilina, contudo, a incidência de doença invasiva grave não diminuiu proporcionalmente (ref. 37).
2.1. A Proteína M e a Classificação emm
A virulência do GAS é centralizada na proteína M, uma molécula dimérica helicoidal que se estende da parede celular. A proteína M confere resistência à fagocitose ao impedir a deposição de opsoninas (C3b) ou ao recrutar inibidores do complemento (Fator H). A tipagem baseada na sequência do gene emm (que codifica a proteína M) substituiu a sorotipagem T e M, identificando mais de 200 tipos (ref. 38). Certos tipos emm (como emm1 e emm3) estão epidemiologicamente ligados a doenças invasivas graves e surtos de febre reumática.
2.2. Superantígenos e o Choque Tóxico
As exotoxinas pirogênicas estreptocócicas (SpeA, SpeB, SpeC, SpeF) funcionam como superantígenos (ref. 39). Ao contrário dos antígenos convencionais que ativam 0,01% das células T, os superantígenos ligam-se externamente ao complexo MHC-II e ao receptor da célula T, ativando até 20% da população de linfócitos T (ref. 40). Isso resulta em uma liberação maciça de citocinas (IL-1, IL-6, TNF-alfa), levando à permeabilidade vascular, hipotensão e falência de múltiplos órgãos característica da Síndrome do Choque Tóxico Estreptocócico (STSS). A presença de bacteremia distingue o STSS do choque tóxico estafilocócico, onde a toxina geralmente é absorvida de um sítio focal sem bacteremia (ref. 41).
2.3. Complicações Pós-Estreptocócicas: Mecanismos Autoimunes
- Febre Reumática: Ocorre após faringite (não após infecções cutâneas) por cepas reumatogênicas (Classe I da proteína M). O mecanismo é o mimetismo molecular: anticorpos contra a proteína M reagem cruzadamente com a miosina cardíaca, laminina valvar e proteínas neuronais (causando a Coreia de Sydenham) (ref. 42). A hipótese PANDAS (distúrbios neuropsiquiátricos autoimunes pediátricos associados a estreptococos) sugere um mecanismo similar afetando os gânglios da base, embora a causalidade direta ainda seja debatida (ref. 43).
- Glomerulonefrite Aguda (GNPE): Pode seguir-se a infecções de faringe ou pele (impetigo). É mediada por complexos imunes (antígeno-anticorpo) que se depositam na membrana basal glomerular, ativando o complemento e causando inflamação. Os antígenos implicados incluem a exotoxina B (SpeB) e o receptor de plasmina associado à nefrite (ref. 44).
2.4. Cenário Terapêutico e Stewardship
Embora a penicilina permaneça a droga de escolha, a falha na erradicação bacteriana em faringites ocorre em até 30% dos casos (ref. 45). Isso não se deve à resistência, mas possivelmente à co-patogenicidade (produção de beta-lactamases por bactérias orais co-colonizadoras que degradam a penicilina) ou à internalização do GAS em células epiteliais. A clindamicina é um adjuvante crucial na fasciíte necrosante e STSS, não apenas pela sua atividade antibacteriana, mas por inibir a síntese proteica, paralisando a produção de toxinas e superantígenos (efeito Eagle) (ref. 46).
3. Streptococcus agalactiae (Grupo B): Mudança de Paradigma Epidemiológico
3.1. O Clone Hipervirulento CC17
A epidemiologia molecular do GBS destaca o complexo clonal 17 (CC17), um “clone hipervirulento” fortemente associado à meningite neonatal de início tardio (ref. 47). Este clone possui adesinas específicas, como a HvgA, que facilitam a translocação através da barreira hematoencefálica e a persistência intestinal. A cápsula polissacarídica rica em ácido siálico mimetiza as estruturas do próprio hospedeiro, permitindo evasão imune e inibição da via alternativa do complemento (ref. 48).
3.2. O Peso da Doença no Adulto
Uma tendência alarmante é o aumento da incidência de GBS invasivo em adultos não gestantes, que agora supera a incidência neonatal em países desenvolvidos (ref. 49). A taxa de letalidade em adultos (>65 anos) é significativamente maior do que em neonatos. As manifestações clínicas incluem celulite (frequentemente em linfedema pós-mastectomia), endocardite destrutiva, artrite séptica (incluindo infecções de prótese articular) e endoftalmite endógena devastadora (ref. 50). O diabetes mellitus é o fator de risco preeminente, presente em mais da metade dos casos adultos (ref. 51).
3.3. Vacinação: A Fronteira Final
A prevenção atual baseada em antibióticos intraparto (IAP) tem limitações: não previne a doença de início tardio, não protege a mãe antes do parto e expõe milhões de mulheres e recém-nascidos a antibióticos, alterando o microbioma infantil (ref. 52). O desenvolvimento de vacinas é a solução de longo prazo.
- Vacinas Conjugadas Hexavalentes: Visam os polissacarídeos capsulares dos sorotipos mais comuns (Ia, Ib, II, III, IV, V). Ensaios clínicos mostram boa imunogenicidade e segurança (ref. 53).
- Vacinas Proteicas: Baseadas nas proteínas de superfície conservadas Alp (Alpha-like proteins) e Rib. A vantagem seria uma cobertura independente do sorotipo capsular, evitando o fenômeno de “substituição de sorotipo” (ref. 54).
4. Streptococcus pneumoniae: O Camaleão da Resistência
4.1. A Cápsula e a Guerra das Vacinas
O S. pneumoniae possui mais de 90 sorotipos capsulares. A introdução das vacinas conjugadas (PCV7, PCV13, PCV15, PCV20) alterou drasticamente a ecologia do pneumococo (ref. 55). Houve uma redução maciça na doença invasiva causada pelos sorotipos vacinais, mas também um fenômeno de “substituição de sorotipo”, onde sorotipos não vacinais (como 19A, 35B) emergiram como novos patógenos (ref. 56). Este jogo de gato e rato exige vigilância contínua para adaptar as formulações vacinais.
4.2. Mecanismos de Resistência e Impacto Clínico
A resistência à penicilina no pneumococo é um processo gradual mediado pela aquisição de genes mosaicos que codificam PBPs (proteínas ligadoras de penicilina) alteradas (PBP1a, PBP2b, PBP2x), reduzindo a afinidade pelo fármaco (ref. 57). Diferente da produção de beta-lactamase, esta resistência pode ser superada com o aumento da dose, exceto no sistema nervoso central.
- Meningite: Devido à baixa penetração de beta-lactâmicos no LCR, define-se resistência com uma CIM (Concentração Inibitória Mínima) muito baixa ($\ge 0.12 \mu g/mL$). O tratamento empírico exige Vancomicina + Ceftriaxona (ou Cefotaxima) para garantir atividade bactericida (ref. 58).
- Pneumonia: A CIM de corte para resistência é muito mais alta ($\ge 8 \mu g/mL$), permitindo o uso de beta-lactâmicos em doses otimizadas para a maioria das cepas “resistentes” (ref. 27). A resistência aos macrolídeos é comum (mediada por efluxo mefA ou metilação ermB) e está frequentemente associada a falhas terapêuticas em pneumonias bacterêmicas, reforçando a necessidade de evitar macrolídeos em monoterapia para doença grave (ref. 59).
5. O Grupo Streptococcus anginosus: Os Construtores de Abscessos
5.1. Taxonomia e Características
O grupo S. anginosus (anteriormente S. milleri) compreende três espécies distintas: S. anginosus, S. constellatus e S. intermedius. Eles são frequentemente microaerófilos, possuem um odor característico de caramelo ou “butterscotch” (devido à produção de diacetil) e formam colônias diminutas em ágar sangue (ref. 60).
5.2. Patogênese Única: O Fator Intermedilisina
A característica clínica definidora deste grupo é a propensão única para formar abscessos profundos (cerebrais, hepáticos, pulmonares) e empiemas. Um fator de virulência chave do S. intermedius é a Intermedilisina (ILY), uma citolisina dependente de colesterol que se liga especificamente à proteína humana CD59 (protetina) nas células do hospedeiro (ref. 61). Esta especificidade para o CD59 humano explica por que modelos animais convencionais muitas vezes falham em replicar a patogenicidade humana deste organismo (ref. 62).
A ILY permite a destruição tecidual e a formação de nichos anaeróbios, onde o S. anginosus frequentemente coopera sinergicamente com bactérias anaeróbias estritas. O isolamento destas bactérias no sangue é um sinal de alerta vermelho (“red flag”) que obriga a investigação por imagem para localizar coleções purulentas ocultas (ref. 63). O tratamento requer não apenas antibióticos prolongados (beta-lactâmicos geralmente funcionam, mas a penetração no abscesso é a chave), mas fundamentalmente a drenagem cirúrgica ou percutânea.
6. Streptococcus gallolyticus: O Sentinela Oncológico
O S. gallolyticus subsp. gallolyticus (membro do Grupo D, anteriormente S. bovis biotipo I) merece destaque especial na governança clínica. Existe uma associação epidemiológica robusta entre a bacteremia ou endocardite por este organismo e o câncer colorretal (ou pólipos adenomatosos pré-malignos) (ref. 64). Mecanisticamente, a bactéria possui proteínas de superfície (pilus Pil1) que se ligam avidamente ao colágeno exposto e mucinas suprarreguladas nos tecidos tumorais (ref. 65). Além disso, o S. gallolyticus pode ativamente promover a proliferação tumoral através do aumento da expressão de beta-catenina e c-Myc nas células hospedeiras, sugerindo um papel co-carcinogênico (ref. 66).
Implicação Prática: A identificação de S. gallolyticus numa hemocultura é uma indicação absoluta para colonoscopia diagnóstica. O profissional de controle de infecção deve garantir que este fluxo de cuidado esteja protocolado na instituição (ref. 67).
7. Os “Outros” Cocos: Raros mas Relevantes
7.1. Variantes Nutricionais (Abiotrophia e Granulicatella)
Anteriormente conhecidos como estreptococos nutricionalmente variantes, Abiotrophia defectiva e Granulicatella adiacens requerem piridoxal (vitamina B6) ou cisteína para crescer. Em hemoculturas padrão, podem crescer nos frascos (que contêm nutrientes do sangue lisado) mas falham em crescer no subcultivo em ágar sangue padrão, levando a diagnósticos de “hemocultura falso-positiva” ou “cultura negativa”. Eles crescem como satélites ao redor de colônias de S. aureus (que fornecem piridoxal). São causas importantes de endocardite de cultura negativa, com altas taxas de falência terapêutica e embolização (ref. 68).
7.2. Leuconostoc e Pediococcus
Estes organismos, frequentemente encontrados em alimentos fermentados, são clinicamente relevantes por sua resistência intrínseca à vancomicina (mecanismo semelhante ao VanA, com terminais D-Ala-D-Lactato naturais). Eles podem ser confundidos com estreptococos viridans ou enterococos resistentes. A infecção ocorre geralmente em pacientes imunocomprometidos ou com cateteres de longa permanência. A identificação correta é vital para evitar o uso inútil de glicopeptídeos; a penicilina ou ampicilina geralmente permanecem ativas (ref. 69).
7.3. Streptococcus suis
Um patógeno zoonótico emergente associado ao contato com suínos ou consumo de carne de porco crua. É uma causa frequente de meningite em adultos na Ásia (Vietnã, Tailândia, China). Uma característica clínica marcante é a perda auditiva neurossensorial (surdez) precoce e profunda, que ocorre em mais de 50% dos casos de meningite, muito mais frequente do que em outras meningites bacterianas (ref. 70). Surtos humanos na China revelaram cepas altamente virulentas capazes de causar síndrome de choque tóxico semelhante ao do GAS.
8. Stewardship de Antimicrobianos e Controle de Infecção
Para os alunos de pós-graduação, a gestão destes patógenos vai além da farmacologia; envolve políticas institucionais.
8.1. Diagnóstico Rápido
A tecnologia MALDI-TOF MS revolucionou a microbiologia destes cocos, permitindo, por exemplo, a diferenciação rápida entre S. pneumoniae e S. mitis (que podem ser muito similares bioquimicamente) e a identificação precisa de anaeróbios facultativos. Painéis moleculares de hemocultura (PCR multiplex) detectam genes de resistência (vanA/B, mecA) em horas, permitindo o descalonamento da vancomicina para ampicilina em casos de E. faecalis sensível muito antes do resultado da cultura tradicional (ref. 27).
8.2. Prevenção da Transmissão de VRE
A contaminação ambiental por VRE é um desafio logístico. O VRE sobrevive em superfícies secas por semanas. A limpeza terminal com tecnologias “no-touch” (luz UV-C, peróxido de hidrogênio vaporizado) provou ser um adjuvante valioso à limpeza manual (ref. 8). A higiene das mãos com álcool é eficaz (diferente do C. difficile), mas a adesão permanece o elo fraco. A triagem retal ativa para VRE em unidades de alto risco (UTI, transplante) permite o isolamento de contato precoce, embora a relação custo-benefício desta prática seja debatida em cenários de alta endemicidade.
8.3. Uso Racional de Antibióticos
O uso excessivo de cefalosporinas de terceira geração e fluoroquinolonas e clindamicina é um motor ecológico potente para a seleção de VRE e C. difficile. O stewardship deve focar na redução do uso destas classes. O tratamento de bacteriúria assintomática por enterococo é um erro comum que deve ser erradicado; a presença de enterococo na urina de pacientes cateterizados raramente requer tratamento, a menos que haja sinais sistêmicos de infecção, e o tratamento desnecessário apenas seleciona resistência (ref. 32).
9. Conclusão
Os gêneros Streptococcus e Enterococcus abrangem uma vasta gama de organismos que se adaptaram com sucesso aos hospedeiros humanos. Seu impacto clínico é profundo, variando da enorme carga global de pneumonia pneumocócica e das tragédias autoimunes da febre reumática causada por S. pyogenes, às infecções oportunistas e altamente resistentes impulsionadas por E. faecium em ambientes de saúde modernos. A trajetória histórica do agrupamento fenotípico à dissecação genômica revelou os mecanismos de sua virulência — como a proteína M do GAS, a cápsula do pneumococo e os elementos de resistência genética móveis dos enterococos. À medida que a resistência aos antibióticos continua a aumentar, particularmente com VRE e estreptococos resistentes a macrolídeos, o desenvolvimento de novas vacinas (ex: para GBS e GAS) e estratégias terapêuticas (como a sinergia de duplo beta-lactâmico) permanece uma prioridade crítica para a pesquisa em doenças infecciosas.
A trajetória de Streptococcus e Enterococcus evidencia uma verdade incômoda: subestimar microrganismos “conhecidos” é uma falha estratégica grave. A ascensão de cepas multirresistentes, a plasticidade genética, o impacto clínico devastador e as lacunas nas práticas assistenciais impõem uma mudança de mentalidade.
O futuro do controle de infecção não repousa apenas em novos antibióticos, mas na integração inteligente entre vigilância epidemiológica ativa, diagnóstico rápido, stewardship rigoroso e formação crítica dos profissionais. Enquanto esses patógenos se reinventam biologicamente, o profissional de saúde precisa evoluir intelectualmente. Quem não compreender essa dinâmica continuará reagindo — quando deveria estar antecipando.
10. REFERÊNCIAS BIBLIOGRÁFICAS
- MURRAY, P. R.; ROSENTHAL, K. S.; PFALLER, M. A. Medical Microbiology. 9. ed. Philadelphia: Elsevier, 2021. Disponível em: https://www.elsevier.com/books/medical-microbiology/murray/978-0-323-67322-8
- ARIAS, C. A. et al. The Enterprise of Enterococcus: An Update on a Successful Pathogen. Clinical Microbiology Reviews, v. 36, n. 3, 2023. Disponível em: https://doi.org/10.1128/cmr.00123-22
- O’NEILL, J. Tackling Drug-Resistant Infections Globally: Final Report and Recommendations. London: Review on Antimicrobial Resistance, 2016. Disponível em: https://amr-review.org/sites/default/files/160518_Final%20paper_with%20cover.pdf
- BROUWER, S. et al. Pathogenesis, epidemiology and control of Group A Streptococcus infection. Nature Reviews Microbiology, v. 21, p. 431–447, 2023. Disponível em: https://doi.org/10.1038/s41579-023-00893-4
- GILMORE, M. S. et al. Enterococci: From Commensals to Leading Causes of Drug Resistant Infection. Updated Edition. Boston: Massachusetts Eye and Ear Infirmary, 2020. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK190423/
- CDC. Antibiotic Resistance Threats in the United States, 2019. Atlanta, GA: U.S. Department of Health and Human Services, 2019. Disponível em: https://www.cdc.gov/drugresistance/pdf/threats-report/2019-ar-threats-report-508.pdf
- JIANG, S. et al. Streptococcus anginosus group infections: Current status and trends. Frontiers in Microbiology, v. 11, p. 624, 2020. Disponível em: https://doi.org/10.3389/fmicb.2020.00624
- ESCMID. ESCMID Guidelines for the Management of Infection. Basel: ESCMID, 2024. Disponível em: https://www.escmid.org/guidelines-publications/guidelines
- THIERCELIN, M. E. Sur un diplocoque enterogene (Enterocoque). C. R. Soc. Biol., v. 51, p. 269–271, 1899. Disponível em: https://gallica.bnf.fr/ark:/12148/bpt6k65711895/f283.item
- SHERMAN, J. M. The streptococci. Bacteriological Reviews, v. 1, n. 1, p. 3-97, 1937. Disponível em: https://doi.org/10.1128/br.1.1.3-97.1937
- SCHLEIFER, K. H.; KILPPER-BALZ, R. Transfer of Streptococcus faecalis and Streptococcus faecium to the genus Enterococcus. International Journal of Systematic Bacteriology, v. 34, n. 1, p. 31-34, 1984. Disponível em: https://doi.org/10.1099/00207713-34-1-31
- LEBRETON, F. et al. Tracing the Enterococci from Paleozoic Origins to the Hospital. Cell, v. 169, n. 5, p. 849-861, 2017. Disponível em: https://doi.org/10.1016/j.cell.2017.04.027
- TEIXEIRA, L. M. et al. Enterococcus. In: Manual of Clinical Microbiology. 13th ed. Washington, DC: ASM Press, 2023. Disponível em: https://www.wiley.com/en-us/Manual+of+Clinical+Microbiology%2C+13th+Edition-p-9781683674290
- PROCADE. Manual de Microbiologia Clínica. 8. ed. São Paulo: Sociedade Brasileira de Microbiologia, 2022. Disponível em: https://sbmicrobiologia.org.br/publicacoes/
- MANERO, A.; BLANCH, A. R. Identification of Enterococcus spp. with a biochemical key. Applied and Environmental Microbiology, v. 65, n. 10, p. 4425–4430, 1999. Disponível em: https://doi.org/10.1128/AEM.65.10.4425-4430.1999
- WILLEMS, R. J. et al. Global spread of vancomycin-resistant Enterococcus faecium from distinct nosocomial genetic complex. Emerging Infectious Diseases, v. 11, n. 6, p. 821–828, 2005. Disponível em: https://doi.org/10.3201/eid1106.041204
- ZHOU, X. et al. The clade-specific virulence of Enterococcus faecium. Virulence, v. 11, n. 1, p. 1393-1408, 2020. Disponível em: https://doi.org/10.1080/21505594.2020.1830876
- PALMER, K. L.; GILMORE, M. S. Multidrug-resistant enterococci lack CRISPR-cas. mBio, v. 1, n. 4, p. e00227-10, 2010. Disponível em: https://doi.org/10.1128/mBio.00227-10
- HEGARTY, J. P. et al. CRISPR-Cas systems in Enterococcus faecalis. Molecular Genetics and Genomics, v. 295, p. 1381–1393, 2020. Disponível em: https://doi.org/10.1007/s00438-020-01708-3
- FISHER, K.; PHILLIPS, C. The ecology, epidemiology and virulence of Enterococcus. Microbiology, v. 155, n. 6, p. 1749–1757, 2009. Disponível em: https://doi.org/10.1099/mic.0.026385-0
- CLEWELL, D. B. Movable genetic elements and antibiotic resistance in enterococci. European Journal of Clinical Microbiology & Infectious Diseases, v. 9, p. 90–102, 1990. Disponível em: https://doi.org/10.1007/BF01963633
- SHANKAR, V. et al. The Enterococcus faecalis surface protein Esp is important for biofilm formation. Infection and Immunity, v. 69, n. 10, p. 6333–6342, 2001. Disponível em: https://doi.org/10.1128/IAI.69.10.6333-6342.2001
- NALLAPAREDDY, S. R. et al. The collagen adhesion protein (Ace) of Enterococcus faecalis. Infection and Immunity, v. 68, n. 9, p. 5218–5224, 2000. Disponível em: https://doi.org/10.1128/IAI.68.9.5218-5224.2000
- SINGH, K. V. et al. Ebp pili of Enterococcus faecalis are important for biofilm formation. Journal of Bacteriology, v. 197, n. 19, 2015. Disponível em: https://doi.org/10.1128/JB.00454-15
- QIN, X. et al. Fsr, an Enterococcus faecalis regulator that controls extracellular protease. Infection and Immunity, v. 68, n. 5, p. 2579–2586, 2000. Disponível em: https://doi.org/10.1128/IAI.68.5.2579-2586.2000
- KAJFASZ, J. K. et al. Oxidative stress response pathways in Enterococcus faecalis. Current Opinion in Microbiology, v. 30, p. 46–52, 2016. Disponível em: https://doi.org/10.1016/j.mib.2016.01.004
- BrCAST. Tabelas de Pontos de Corte para Interpretação de CIMs e Diâmetros de Halos. Versão 14.1. Brasília: BrCast, 2024. Disponível em: http://brcast.org.br/documentos/
- CETINKAYA, Y. et al. Vancomycin-resistant enterococci. Clinical Microbiology Reviews, v. 13, n. 4, p. 686–707, 2000. Disponível em: https://doi.org/10.1128/CMR.13.4.686
- ARTHUR, M.; COURVALIN, P. Genetics and mechanisms of glycopeptide resistance in enterococci. Antimicrobial Agents and Chemotherapy, v. 37, n. 8, p. 1563–1571, 1993. Disponível em: https://doi.org/10.1128/AAC.37.8.1563
- EVERS, S. et al. Structural and functional analysis of the vanB gene cluster. Gene, v. 140, n. 1, p. 97-102, 1994. Disponível em: https://doi.org/10.1016/0378-1119(94)90776-5
- REYNOLDS, P. E.; COURVALIN, P. Vancomycin resistance in Enterococcus faecium BM4147. Biochemistry, v. 44, n. 5, p. 1806–1817, 2005. Disponível em: https://doi.org/10.1021/bi0481345
- DELGADO, V. et al. 2023 ESC Guidelines for the management of infective endocarditis. European Heart Journal, v. 44, n. 39, p. 3948–4042, 2023. Disponível em: https://doi.org/10.1093/eurheartj/ehad586
- GAVALDÀ, J. et al. Brief communication: treatment of Enterococcus faecalis endocarditis with ampicillin plus ceftriaxone. Annals of Internal Medicine, v. 146, n. 8, p. 574–579, 2007. Disponível em: https://doi.org/10.7326/0003-4819-146-8-200704170-00008
- BRITT, N. S. et al. High-Dose Daptomycin for Treatment of Vancomycin-Resistant Enterococcus faecium Infections. Antimicrobial Agents and Chemotherapy, v. 61, n. 5, p. e02389-16, 2017. Disponível em: https://doi.org/10.1128/AAC.02389-16
- SAKOULAS, G. et al. Antimicrobial salvage therapy for persistent Staphylococcal bacteremia using daptomycin plus ceftaroline. Clinical Therapeutics, v. 36, n. 10, p. 1317–1333, 2014. Disponível em: https://doi.org/10.1016/j.clinthera.2014.06.013
- BI, R. et al. High prevalence of the optrA gene in linezolid-resistant enterococci. International Journal of Antimicrobial Agents, v. 60, n. 2, 2022. Disponível em: https://doi.org/10.1016/j.ijantimicag.2022.106600
- RALPH, A. P.; CARAPETIS, J. R. Group A streptococcal diseases and their global burden. Current Topics in Microbiology and Immunology, v. 368, p. 1–27, 2013. Disponível em: https://doi.org/10.1007/82_2012_280
- NELSON, G. E. et al. Epidemiology of invasive group A streptococcal infections in the United States, 2005-2012. Clinical Infectious Diseases, v. 63, n. 4, p. 478–486, 2016. Disponível em: https://doi.org/10.1093/cid/ciw248
- MCCORMICK, J. K. et al. Superantigens in clinical medicine. Immunology and Allergy Clinics of North America, v. 31, n. 4, p. 733–754, 2011. Disponível em: https://doi.org/10.1016/j.iac.2011.09.001
- PROFT, T.; FRASER, J. D. Bacterial superantigens. Clinical and Experimental Immunology, v. 133, n. 3, p. 299–306, 2003. Disponível em: https://doi.org/10.1046/j.1365-2249.2003.02199.x
- LAPPIN, E.; FERGUSON, A. J. Gram-positive toxic shock syndromes. Lancet Infectious Diseases, v. 9, n. 5, p. 281–290, 2009. Disponível em: https://doi.org/10.1016/S1473-3099(09)70066-0
- CUNNINGHAM, M. W. Pathogenesis of group A streptococcal infections. Clinical Microbiology Reviews, v. 13, n. 3, p. 470–511, 2000. Disponível em: https://doi.org/10.1128/CMR.13.3.470
- SIGRA, S. et al. PANDAS and PANS: Clinical characteristics and pathophysiology. Journal of Neurology, v. 270, p. 18-32, 2023. Disponível em: https://doi.org/10.1007/s00415-022-11349-7
- NASR, S. H. et al. Acute poststreptococcal glomerulonephritis. Nature Reviews Nephrology, v. 9, n. 1, p. 58, 2013. Disponível em: https://doi.org/10.1038/nrneph.2012.283
- PICHERO, M. E. Treatment of Group A streptococcal tonsillopharyngitis: is penicillin still the best? Expert Opin Pharmacother, v. 13, n. 10, 2012. Disponível em: https://doi.org/10.1517/14656566.2012.693165
- STEVENS, D. L. et al. Effect of antibiotics on toxin production and viability of Clostridium perfringens. Antimicrobial Agents and Chemotherapy, v. 31, n. 2, p. 213–218, 1987. Disponível em: https://doi.org/10.1128/AAC.31.2.213
- TAZI, A. et al. The surface protein HvgA mediates group B streptococcus hypervirulence. Journal of Experimental Medicine, v. 207, n. 11, p. 2313–2322, 2010. Disponível em: https://doi.org/10.1084/jem.20092594
- CARLIN, A. F. et al. Molecular mimicry of host sialylated glycans. Blood, v. 113, n. 14, p. 3333–3336, 2009. Disponível em: https://doi.org/10.1182/blood-2008-11-187302
- SKOFF, T. H. et al. Increasing burden of invasive group B streptococcal disease in nonpregnant adults. Clinical Infectious Diseases, v. 49, n. 1, p. 85–92, 2009. Disponível em: https://doi.org/10.1086/599369
- PHIPPS, J. C. et al. Streptococcus agalactiae infections in adults: an emerging problem. Infectious Disease Clinics of North America, v. 35, n. 1, p. 123-138, 2021. Disponível em: https://doi.org/10.1016/j.idc.2020.10.006
- EDWARDS, M. S.; BAKER, C. J. Group B streptococcal infections in elderly adults. Clinical Infectious Diseases, v. 41, n. 6, p. 839–847, 2005. Disponível em: https://doi.org/10.1086/432804
- VERANI, J. R. et al. Prevention of perinatal group B streptococcal disease. MMWR Recommendations and Reports, v. 59, n. RR-10, p. 1-36, 2010. Disponível em: https://www.cdc.gov/mmwr/preview/mmwrhtml/rr5910a1.htm
- HEATH, P. T. Status of vaccine research and development of vaccines for GBS. Vaccine, v. 34, n. 26, p. 2876–2879, 2016. Disponível em: https://doi.org/10.1016/j.vaccine.2015.12.072
- LINDSTRØM, F. et al. Alpha-like protein deficient structural variants of Streptococcus agalactiae. PLoS One, v. 9, n. 10, p. e108869, 2014. Disponível em: https://doi.org/10.1371/journal.pone.0108869
- MOORE, M. R. et al. Impact of the pneumococcal conjugate vaccine on the health of Americans. Lancet Infectious Diseases, v. 15, n. 3, p. 253–255, 2015. Disponível em: https://doi.org/10.1016/S1473-3099(14)71081-3
- WEINBERGER, D. M. et al. Pneumococcal serotype replacement in the era of conjugate vaccines. Lancet Infectious Diseases, v. 11, n. 12, p. 903–904, 2011. Disponível em: https://doi.org/10.1016/S1473-3099(11)70274-5
- HAKENBECK, R. et al. Penicillin-binding proteins in the pathogenic pneumococcus. Future Microbiology, v. 7, n. 3, p. 395–410, 2012. Disponível em: https://doi.org/10.2217/fmb.12.11
- TUNKEL, A. R. et al. Practice guidelines for the management of bacterial meningitis. Clinical Infectious Diseases, v. 39, n. 9, p. 1267–1284, 2004. Disponível em: https://doi.org/10.1086/425368
- LYNCH, J. P.; ZHANEL, G. G. Streptococcus pneumoniae: epidemiology and risk factors. Current Opinion in Pulmonary Medicine, v. 16, n. 3, p. 217–225, 2010. Disponível em: https://doi.org/10.1097/MCP.0b013e3283385653
- WHILEY, R. A.; BEIGHTON, D. Emended descriptions and recognition of Streptococcus constellatus, S. intermedius, and S. anginosus. International Journal of Systematic Bacteriology, v. 41, n. 1, p. 1–5, 1991. Disponível em: https://doi.org/10.1099/00207713-41-1-1
- NAGAMUNE, H. et al. Intermedilysin, a novel cytotoxin specific for human cells. Infection and Immunity, v. 64, n. 8, p. 3093–3100, 1996. Disponível em: https://doi.org/10.1128/IAI.64.8.3093-3100.1996
- SUKWAJJO, P. et al. Human-specific pore-forming toxin, intermedilysin. Microbial Pathogenesis, v. 53, n. 1, p. 18–24, 2012. Disponível em: https://doi.org/10.1016/j.micpath.2012.03.004
- BERTO, F. et al. “Streptococcus milleri” group bacteremia: analysis of 78 cases. Journal of Infection, v. 67, n. 6, p. 618–620, 2013. Disponível em: https://doi.org/10.1016/j.jinf.2013.08.012
- BOLEIJ, A. et al. The clinical importance of Streptococcus gallolyticus infection among colon cancer patients. Clinical Infectious Diseases, v. 53, n. 9, p. 870–878, 2011. Disponível em: https://doi.org/10.1093/cid/cir619
- MARTINS, M. et al. The role of Streptococcus gallolyticus Pil1 in the adhesion to the colon. Scientific Reports, v. 6, art. no. 35698, 2016. Disponível em: https://doi.org/10.1038/srep35698
- KUMAR, R. et al. Streptococcus gallolyticus promotes colorectal cancer proliferation and migration. PLoS Pathogens, v. 13, n. 7, p. e1006440, 2017. Disponível em: https://doi.org/10.1371/journal.ppat.1006440
- CORREDOIRA, J. et al. Association between Streptococcus bovis bacteremia and bowel disease. European Journal of Internal Medicine, v. 31, p. e9-e10, 2016. Disponível em: https://doi.org/10.1016/j.ejim.2016.03.002
- CHRISTENSEN, J. J.; FACKLAM, R. R. Granulicatella and Abiotrophia species from human clinical specimens. Journal of Clinical Microbiology, v. 39, n. 10, p. 3520–3523, 2001. Disponível em: https://doi.org/10.1128/JCM.39.10.3520-3523.2001
- CUMMINS, A. J. et al. Clinical significance and antimicrobial susceptibility of Leuconostoc and Pediococcus species. Eur J Clin Microbiol Infect Dis, v. 32, n. 8, p. 987–993, 2013. Disponível em: https://doi.org/10.1007/s10096-013-1841-z
- WERTHEIM, H. F. et al. Streptococcus suis: an emerging human pathogen. Clinical Infectious Diseases, v. 48, n. 5, p. 617–625, 2009. Disponível em: https://doi.org/10.1086/596763
Autor:
Antonio Tadeu Fernandes:
Médico pela FMUSP com residência em Moléstias Infecciosas no HCFMUSP e mestrado em Medicina Preventiva na FMUSP.
Ex-presidente da APECIH (fundador) e da ABIH.
Autor do livro: “Infecção Hospitalar e suas Interfaces na Área da Saúde” (Prêmio Jabuti como melhor publicação em Ciências Neturais e Saúde).
CEO do Instituto CCIH+
https://www.linkedin.com/in/mba-gest%C3%A3o-ccih-a-tadeu-fernandes-11275529/
https://www.instagram.com/tadeuccih/
Critical Summary: From Commensal to Superbug
This article dissects the evolutionary paradox of Gram-positive cocci (Streptococcus and Enterococcus), challenging the notion that these are “old acquaintances” and easy to manage. The text argues that contemporary clinical practice underestimates the genetic plasticity of these pathogens, resulting in severe therapeutic and diagnostic failures.
Key Analysis Points:
- The Rise of Enterococcus: The article details how the loss of the CRISPR-Cas system in hospital lineages (such as E. faecium Clade A1) transformed these organisms into genetically promiscuous “resistance collectors.” It highlights the shift in therapeutic paradigms, such as the use of Ampicillin + Ceftriaxone synergism for E. faecalis endocarditis (even with aminoglycoside resistance) and the “seesaw effect” in the use of Daptomycin.
- Hidden Virulence Alerts:
- S. gallolyticus and Oncology: The text establishes the identification of this microorganism as a mandatory sentinel marker for colorectal cancer screening, due to the Pil1 protein and its role in tumor proliferation.
- S. anginosus and Abscesses: Defines the isolation of this bacterium in the blood as a “red flag” for the active search for deep abscesses, given its unique capacity for tissue destruction via the Intermedilysin toxin.
- S. pyogenes (GAS): Addresses the paradox of penicillin sensitivity versus the lethality of Toxic Shock, reinforcing the need for Clindamycin to block superantigen production (Eagle Effect).
- Stewardship and Diagnosis: The material criticizes the treatment of asymptomatic bacteriuria by enterococcus and reinforces the role of technologies like MALDI-TOF and multiplex PCR for rapid antibiotic de-escalation.
Conclusion: The article concludes that the battle against these pathogens is not won only with new antibiotics, but with diagnostic intelligence, aggressive terminal cleaning (for VRE), and a deep understanding of pathophysiology that basic textbooks ignore.
#ccih #controledeinfeccao #infectologia #microbiologia #enterococcus #streptococcus #superbacterias #resistenciaabacteriana #stewardship #antimicrobialstewardship #segurancadopaciente #farmaciaclinica #farmaciahospitalar #enfermagem #medicina #biomedicina #analisesclinicas #laboratorio #uti #terapiaintensiva #infectio #epidemiologia #bacteriologia #doencasinfecciosas #sepse #choquetoxico #endocardite #bacteremia #fasciitenecrosante #meningite #pneumonia #abscesso #empiema #cancercolorretal #oncologia #nefrologia #cardiologia #pediatria #neonatologia #veterinaria #zoonose #suinos #alimentos #segurancaalimentar #higienedasmaos #limpezahospitalar #limpezaterminal #desinfeccao #esterilizacao #vacinas #imunizacao #saudepublica #gestaoemsaude #antibioticos #antimicrobianos #usoracionaldemedicamentos #vre #vancomicina #teicoplanina #daptomicina #linezolida #ceftriaxona #ampicilina #clindamicina #penicilina #macrolideos #aminoglicosideos #gentamicina #betalactamicos #cefalosporinas #fluoroquinolonas #enterococcusfaecalis #enterococcusfaecium #streptococcuspyogenes #streptococcusagalactiae #streptococcuspneumoniae #streptococcusanginosus #streptococcusgallolyticus #streptococcussuis #streptococcusbovis #leuconostoc #pediococcus #abiotrophia #granulicatella #malditof #pcr #pcrmultiplex #biologiamolecular #genomica #crispr #crisprcas #biofilme #proteinam #superantigenos #efeitogangorra #seesawEffect #efeitoeagle #intermedilisina #hpc #infeccaohospitalar #iras #sih #scih
Instituto CCIH+ Parceria permanente entre você e os melhores professores na sua área de atuação
Conheça nossos cursos de especialização ou MBA:
MBA Gestão em Saúde e Controle de Infecção
MBA Gestão em Centro de Material e Esterilização
MBA EQS – Gestão da Segurança do Paciente e governança clínica